Trắc nghiệm lý thuyết về sự điện ly-Acid-Base Hóa 11 có đáp án được soạn dưới dạng file word gồm 9 trang. Các bạn xem và tải về ở dưới.
TRẮC NGHIỆM LÝ THUYẾT VỀ SỰ ĐIỆN LY ACID BASE
I. VÍ DỤ MINH HỌA
Câu 1. Thực hiện thí nghiệm như mô tả trên hình bên dưới.
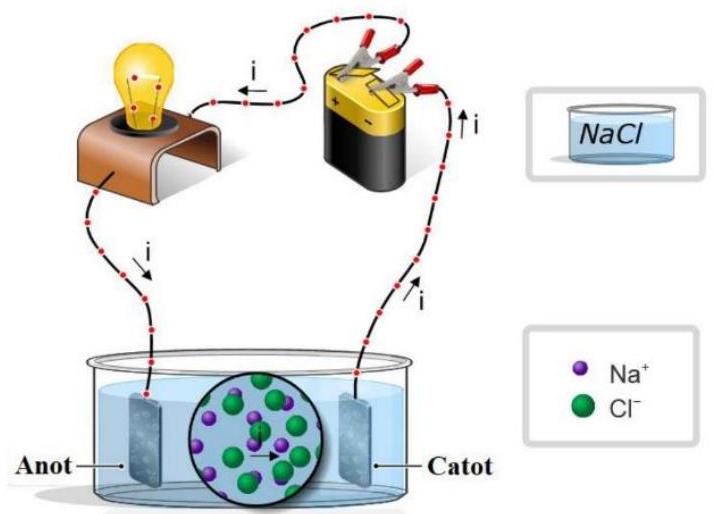
Kết quả bóng đèn sáng chứng tỏ điều gì?
Lời giải
+ Kết quả thu được bóng đèn phát sáng, nghĩa là trong dung dịch muối ăn hòa tan có các hạt mang điện chuyển động tạo nên dòng điện, đó là các ion ${\text{N}}{{\text{a}}^ + }$và ${\text{C}}{{\text{l}}^ – }$do phân tử ${\text{NaCl}}$ phân li tạo thành (sự điện li).
+ Khi đó ta có phương trình điện li của ${\text{NaCl}}$ trong nước như sau:
${\text{NaCl}}\left( {\text{s}} \right) \to {\text{N}}{{\text{a}}^ + }\left( {{\text{aq}}} \right) + {\text{C}}{{\text{l}}^ – }\left( {{\text{aq}}} \right)$
Câu 2. Thực hiện thí nghiệm tương tự với 3 chất tan khác nhau là ethanol, potassium chloride và acid acetic như hình dưới đây.
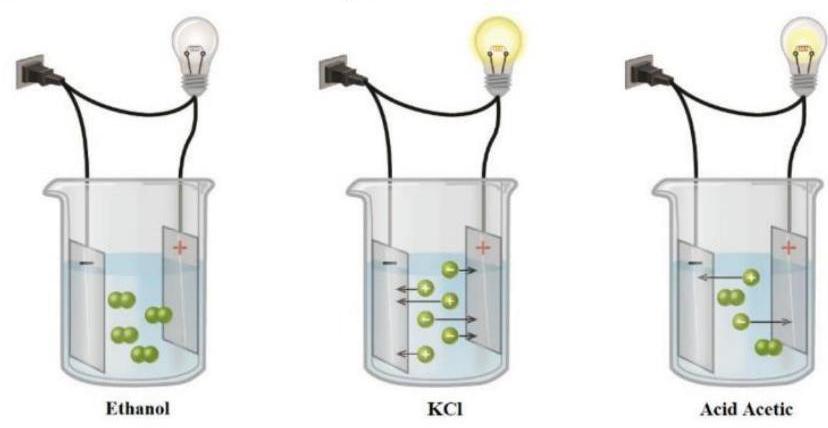
Giải thích kết quả thí nghiệm trên.
Lời giải
+ Kết quả cho thấy dung dịch ${\text{KCl}}$ và acetic acid có khả năng dẫn điện làm bóng đèn sáng, còn dung dịch hòa tan ethanol lại không dẫn điện $ \to {\text{KCl}}$ và acetic acid là chất điện li còn ethanol là chất không điện li.
+ Dung dịch ${\text{KCl}}$ làm cho bóng đèn sang hơn dung dịch acetic acid chứng tỏ khả năng phân li ra ion của ${\text{KCl}}$ mạnh hơn $ \to {\text{KCl}}$ là chất điện li mạnh, acetic acid là chất điện li yếu.
Câu 3. ${\text{HCl}}$ phân li trong nước theo phương trình sau:
${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
Trong dung dịch nước của acetic acid tồn tại cân bằng sau:
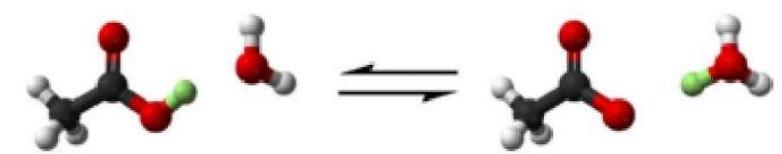
${\text{C}}{{\text{H}}_3}{\text{COOH}} + {{\text{H}}_2}{\text{O}} \rightleftharpoons {\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – } + {{\text{H}}_3}{{\text{O}}^ + }$
Giải thích sự khác nhau của sự phân li ${\text{HCl}}$ và ${\text{CH}}3{\text{COOH}}$ trong dung dịch nước.
Lời giải
${\text{HCl}}$ và ${\text{C}}{{\text{H}}_3}{\text{COOH}}$ đều là acid, tuy nhiên khi điện li lại có sự khác nhau. Sự khác nhau này là do ${\text{HCl}}$ khi hòa tan sẽ phân li hoàn toàn thành các ion, trong dung dịch không còn phân tử ${\text{HCl}}$. Ngược lại ${\text{C}}{{\text{H}}_3}{\text{COOH}}$ lại không phân li hoàn toàn mà trong dung dịch tồn tại đồng thời cả dạng phân tử và các ion.
$ \to {\text{HCl}}$ là acid mạnh, acetic acid là acid yếu.
II. BÀI TẬP TRẮC NGHIỆM
Câu 1. Qúa trình phân li các chất tan khi trong nước tạo thành các ion gọi là:
A. Sự điện li.
B. Sự điện phân.
C. Sự li tâm.
D. Sự ăn mòn.
Câu 2. Trong dung dịch acid nitric (bỏ qua sự phân li của ${{\text{H}}_2}{\text{O}}$ ) có những phần tử nào ?
A. ${{\text{H}}^ + },{\text{N}}{{\text{O}}_3}{\;^ – }$.
B. ${{\text{H}}^ + },{\text{N}}{{\text{O}}_3}{\;^ – },{{\text{H}}_2}{\text{O}}$.
C. ${{\text{H}}^ + },{\text{N}}{{\text{O}}_3}{\;^ – },{\text{HN}}{{\text{O}}_3}$.
D. ${{\text{H}}^ + },{\text{N}}{{\text{O}}_3}{\;^ – },{\text{HN}}{{\text{O}}_3},{{\text{H}}_2}{\text{O}}$.
Câu 3. Chất nào sau đây là chất điện li mạnh?
A. ${\text{NaCl}}$
B. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$
C. ${{\text{H}}_2}{\text{O}}$
D. HF
Câu 4. Chất nào sau đây là chất điện li?
A. ${\text{HCl}}$
B. ${{\text{C}}_6}{{\text{H}}_6}$
C. ${\text{C}}{{\text{H}}_4}$
D. ${{\text{C}}_2}{{\text{H}}_5}{\text{OH}}$
Câu 5. Phương trình điện li nào sau đây không đúng?
A. ${\text{C}}{{\text{H}}_3}{\text{COOH}} \rightleftarrows {\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – } + {{\text{H}}^ + }$
B. ${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
C. ${{\text{H}}_3}{\text{P}}{{\text{O}}_4} \to 3{{\text{H}}^ + } + {\text{P}}{{\text{O}}_4}{\;^{3 – }}$
D. ${\text{N}}{{\text{a}}_3}{\text{P}}{{\text{O}}_4} \to 3{\text{N}}{{\text{a}}^ + } + {\text{P}}{{\text{O}}_4}{\;^{3 – }}$
Câu 6. Dung dịch nào sau đây không dẫn điện được ?
A. ${\text{Ca}}{({\text{OH}})_2}$
B. ${\text{C}}{{\text{H}}_3}{\text{OH}}$
C. ${\text{HCl}}$
D. ${\text{A}}{{\text{l}}_2}{\left( {{\text{S}}{{\text{O}}_4}} \right)_3}$
Câu 7. Chất nào dưới đây thuộc loại chất điện li yếu?
A. HF.
B. ${\text{KCl}}$.
C. ${\text{NaOH}}$.
D. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$.
Câu 8. Chất nào dưới đây thuộc loại chất điện li?
A. Glucose.
B. Alcol etylic.
C. ${\text{KCl}}$
D. Aceton.
Câu 9. Dãy gồm các chất đều là chất điện li yếu là:
A. ${\text{N}}{{\text{a}}_2}{\text{S}}{{\text{O}}_3},{\text{NaOH}},{\text{CaC}}{{\text{l}}_2},{\text{C}}{{\text{H}}_3}{\text{COOH}}$.
B. ${{\text{H}}_2}{\text{S}},{{\text{H}}_3}{\text{P}}{{\text{O}}_4},{\text{C}}{{\text{H}}_3}{\text{COOH}},{\text{Cu}}{({\text{OH}})_2}$.
C. ${\text{N}}{{\text{a}}_2}{\text{S}}{{\text{O}}_4},{{\text{H}}_2}{\text{S}},{\text{CaC}}{{\text{O}}_3},{\text{HgC}}{{\text{l}}_2}$.
D. ${\text{CuS}}{{\text{O}}_4},{\text{NaCl}},{\text{HCl}},{\text{NaOH}}$.
Câu 10. Chất nào dưới đây không phải chất điện li?
A. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$.
B. ${{\text{C}}_2}{{\text{H}}_5}{\text{OH}}$.
C. ${{\text{H}}_2}{\text{O}}$.
D. ${\text{CuS}}{{\text{O}}_4}$
Câu 11. Cho các chất sau: ${{\text{H}}_2}{\text{C}}{{\text{O}}_3},{\text{A}}{{\text{l}}_2}{\left( {{\text{S}}{{\text{O}}_4}} \right)_3},{\text{HN}}{{\text{O}}_3}$, glucozơ, ${{\text{C}}_2}{{\text{H}}_5}{\text{OH}},{\text{NaOH}}$, ${\text{C}}{{\text{H}}_3}{\text{COOH}},{\text{Ba}}{({\text{OH}})_2}$, HF. số chất điện li mạnh là:
A. 3 .
B. 4 .
C. 5 .
D. 6 .
Câu 12. Phương trình điện li nào dưới đây được viết đúng ?
A. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4} \rightleftarrows {{\text{H}}^ + } + {\text{HSO}}_4^ – $
B. ${{\text{H}}_2}{\text{C}}{{\text{O}}_3} \rightleftarrows {{\text{H}}^ + } + {\text{HCO}}_3^ – $
C. ${{\text{H}}_2}{\text{S}}{{\text{O}}_3} \rightleftarrows 2{{\text{H}}^ + } + {\text{S}}{{\text{O}}_3}{\;^{2 – }}$
D. ${\text{N}}{{\text{a}}_2}{\text{S}} \rightleftarrows 2{\text{N}}{{\text{a}}^ + } + {{\text{S}}^{2 – }}$
Câu 13. Chất nào sau đây không phải chất điện li trong nước?
A. ${\text{HCl}}$.
B. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$.
C. ${{\text{C}}_6}{{\text{H}}_{12}}{{\text{O}}_6}$.
D. ${\text{NaOH}}$.
Câu 14. Chất nào sau đây là chất điện li mạnh:
A. ${\text{HCl}}$.
B. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$.
C. ${\text{Al}}{({\text{OH}})_3}$.
D. ${{\text{C}}_6}{{\text{H}}_{12}}{{\text{O}}_6}$.
Câu 15. Dãy chất nào dưới đây chỉ gồm những chất tan và điện li mạnh?
A. ${\text{HN}}{{\text{O}}_3},{\text{Cu}}{\left( {{\text{N}}{{\text{O}}_3}} \right)_2},{\text{C}}{{\text{a}}_3}{\left( {{\text{P}}{{\text{O}}_4}} \right)_2},{{\text{H}}_3}{\text{P}}{{\text{O}}_4}$
B. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4},{\text{NaCl}},{\text{KN}}{{\text{O}}_3},{\text{Ba}}{\left( {{\text{N}}{{\text{O}}_3}} \right)_2}$
C. ${\text{CaC}}{{\text{l}}_2},{\text{CuS}}{{\text{O}}_4},{\text{CaS}}{{\text{O}}_4},{\text{HN}}{{\text{O}}_3}$
D. ${\text{KCl}},{{\text{H}}_2}{\text{S}}{{\text{O}}_4},{{\text{H}}_2}{\text{O}},{\text{CaC}}{{\text{l}}_2}$
Câu 16. Trong số các chất sau: ${\text{HN}}{{\text{O}}_2},{\text{C}}{{\text{H}}_3}{\text{COOH}},{\text{KMn}}{{\text{O}}_4},{{\text{C}}_6}{{\text{H}}_6},{\text{HCOOH}},{\text{HCOOC}}{{\text{H}}_3}$, ${{\text{C}}_6}{{\text{H}}_{12}}{{\text{O}}_6},{{\text{C}}_2}{{\text{H}}_5}{\text{OH}},{\text{S}}{{\text{O}}_2},{\text{C}}{{\text{l}}_2},{\text{NaClO}},{\text{C}}{{\text{H}}_4},{\text{NaOH}},{\text{N}}{{\text{H}}_3},{{\text{H}}_2}{\text{S}}$. Số chất thuộc loại chất điện li là:
A. 8
B. 7
C. 9
D. 10
Câu 17. Trong dung dịch acid acetic (bỏ qua sự phân li của ${{\text{H}}_2}{\text{O}}$ ) có những phần tử nào?
A. ${{\text{H}}^ + },{\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }$
B. ${{\text{H}}^ + },{\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – },{{\text{H}}_2}{\text{O}}$
C. ${\text{C}}{{\text{H}}_3}{\text{COOH}},{{\text{H}}^ + },{\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – },{{\text{H}}_2}{\text{O}}$
D. ${\text{C}}{{\text{H}}_3}{\text{COOH}},{\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – },{{\text{H}}^ + }$
Câu 18. Dãy các chất đều là chất điện li mạnh là
A. ${\text{KOH}},{\text{NaCl}},{{\text{H}}_2}{\text{C}}{{\text{O}}_3}$.
B. ${\text{N}}{{\text{a}}_2}{\text{S}},{\text{Mg}}{({\text{OH}})_2},{\text{HCl}}$.
C. ${\text{HClO}},{\text{NaN}}{{\text{O}}_3},{\text{Ca}}{({\text{OH}})_2}$.
D. ${\text{HCl}},{\text{Fe}}{\left( {{\text{N}}{{\text{O}}_3}} \right)_3},{\text{Ba}}{({\text{OH}})_2}$
Câu 19. Chất nào sau đây điện li không hoàn toàn khi tan trong nước ?
A. ${{\text{K}}_2}{\text{C}}{{\text{O}}_3}$
B. ${\text{N}}{{\text{H}}_4}{\text{N}}{{\text{O}}_3}$
C. ${\text{Ca}}{({\text{OH}})_2}$
D. ${{\text{H}}_3}{\text{P}}{{\text{O}}_4}$
Câu 20. Cho các chất sau: ${{\text{K}}_3}{\text{P}}{{\text{O}}_4},{{\text{H}}_2}{\text{S}}{{\text{O}}_4},{\text{HClO}},{\text{HN}}{{\text{O}}_2},{\text{N}}{{\text{H}}_4}{\text{Cl}},{\text{Mg}}{({\text{OH}})_2}$. Các chất điện li yếu là:
A. ${\text{HClO}},{\text{HN}}{{\text{O}}_2},{\text{}}{{\text{K}}_3}{\text{P}}{{\text{O}}_4}$.
B. ${\text{HClO}},{\text{HN}}{{\text{O}}_2},{\text{Mg}}{({\text{OH}})_2}$.
C. ${\text{Mg}}{({\text{OH}})_2},{\text{N}}{{\text{H}}_4}{\text{Cl}},{\text{HN}}{{\text{O}}_2}$
D. ${\text{Mg}}{({\text{OH}})_2},{\text{HN}}{{\text{O}}_2},{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$.
Câu 21. Chất nào sau đây là chất điện li yếu?
A. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$.
B. ${{\text{H}}_2}{\text{S}}$.
C. ${\text{Ba}}{({\text{OH}})_2}$.
D. ${{\text{K}}_3}{\text{P}}{{\text{O}}_4}$.
Câu 22. Cho các dung dịch có cùng nồng độ mol 0,1 ${\text{M}}:{\text{NaCl}},{\text{C}}{{\text{H}}_3}{\text{COOH}},{\text{N}}{{\text{H}}_3},{{\text{C}}_2}{{\text{H}}_5}{\text{OH}}$. Dung dịch có độ dẫn điện tốt nhất là
A. ${\text{NaCl}}$
B. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$
C. ${\text{N}}{{\text{H}}_3}$
D. ${{\text{C}}_2}{{\text{H}}_5}{\text{OH}}$
Câu 23. Trong dung dịch acid nitric (bỏ qua sự phân li của ${{\text{H}}_2}{\text{O}}$ ) có những phần tử nào ?
A. ${{\text{H}}^ + },{\text{NO}}_3^ – $.
B. ${{\text{H}}^ + },{\text{NO}}_3^ – ,{{\text{H}}_2}{\text{O}}$.
C. ${{\text{H}}^ + },{\text{NO}}_3^ – ,{\text{HN}}{{\text{O}}_3}$.
D. ${{\text{H}}^ + },{\text{NO}}_3^ – ,{\text{HN}}{{\text{O}}_3},{{\text{H}}_2}{\text{O}}$.
Câu 24. Theo thuyết BrØnsted – Lowry về acid – base, những chất có khả năng cho ${{\text{H}}^ + }$là:
A. Acid
B. Base
C. Lưỡng tính
D. Muối
Câu 25. Theo thuyết BrØnsted – Lowry về acid – base, những chất có khả năng nhận ${{\text{H}}^ + }$ là:
A. Acid
B. Base
C. Lưỡng tính
D. Muối
Câu 26. Acid nào sau đây phân li hoàn toàn trong nước:
A. ${{\text{H}}_3}{\text{P}}{{\text{O}}_4}$
B. ${{\text{H}}_2}{\text{S}}$
C. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$
D. HF
Câu 27. Acid nào sau đây không phân li hoàn toàn trong nước:
A. ${\text{HCl}}$
B. ${\text{HCl}}{{\text{O}}_4}$
C. ${\text{HN}}{{\text{O}}_3}$
D. ${{\text{H}}_2}{\text{C}}{{\text{O}}_3}$
Câu 28. Base nào sau đây phân li hoàn toàn trong nước:
A. ${\text{KOH}}$
B. ${\text{Cu}}{({\text{OH}})_2}$
C. ${\text{N}}{{\text{H}}_3}{\text{OH}}$
D. ${\text{Fe}}{({\text{OH}})_3}$
Câu 29. Base nào sau đây không phân li hoàn toàn trong nước:
A. ${\text{Ba}}{({\text{OH}})_2}$
B. ${\text{NaOH}}$
C. ${\text{Ca}}{({\text{OH}})_2}$
D. ${\text{Al}}{({\text{OH}})_3}$
Câu 30. Theo thuyết BrØnsted – Lowry về acid – base, chất nào sau đây là acid:
A. ${\text{N}}{{\text{H}}_3}$
B. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$
C. ${{\text{C}}_2}{{\text{H}}_5}{\text{OH}}$
D. ${{\text{C}}_6}{{\text{H}}_{12}}{{\text{O}}_6}$
Câu 31. Theo thuyết BrØnsted – Lowry về acid – base, ion nào sau đây không phải là acid:
A. ${\text{A}}{{\text{l}}^{3 + }}$
B. ${\text{NH}}_4^ + $
C. ${{\text{H}}_3}{{\text{O}}^ + }$
D. ${\text{P}}{{\text{O}}_4}{\;^{3 – }}$
Câu 32. Theo thuyết BrØnsted – Lowry về acid – base, ion nào sau đây là acid:
A. ${\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }$
B. ${\text{C}}{{\text{O}}_3}{\;^{2 – }}$
C. ${\text{S}}{{\text{O}}_3}{\;^{2 – }}$
D. ${\text{A}}{{\text{l}}^{3 + }}$
Câu 33. Theo thuyết BrØnsted – Lowry về acid – base, chất nào sau đây là base:
A. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$
B. ${\text{HCl}}$
C. ${\text{N}}{{\text{H}}_3}$
D. HF
Câu 34. Trong phương trình sau: ${\text{C}}{{\text{H}}_3}{\text{COOH}} + {{\text{H}}_2}{\text{O}} \rightleftharpoons {{\text{H}}_3}{{\text{O}}^ + } + {\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }$, theo phản ứng thuận, ion hay chất nào đóng vai trò acid?
A. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$
B. ${{\text{H}}_2}{\text{O}}$
C. ${{\text{H}}_3}{{\text{O}}^ + }$
D. ${\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }$
Câu 35. Trong phương trình sau: ${\text{C}}{{\text{H}}_3}{\text{COOH}} + {{\text{H}}_2}{\text{O}} \rightleftharpoons {{\text{H}}_3}{{\text{O}}^ + } + {\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }$, theo phản ứng nghịch, ion hay chất nào đóng vai trò base?
A. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$
B. ${{\text{H}}_2}{\text{O}}$
C. ${{\text{H}}_3}{{\text{O}}^ + }$
D. ${\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }$
Câu 36. Cho phương trình: ${{\text{S}}^{2 – }} + {{\text{H}}_2}{\text{O}} \rightleftharpoons {\text{H}}{{\text{S}}^ – } + {\text{O}}{{\text{H}}^ – }$. Phát biểu nào sau đây là đúng?
A. ${{\text{H}}_2}{\text{O}}$ là base.
B. ${{\text{S}}^{2 – }}$ là base.
C. HS- là base.
D. ${{\text{S}}^{2 – }}$ là acid.
Câu 37. Cho phương trình: ${\text{N}}{{\text{H}}_4}{\;^ + } + {{\text{H}}_2}{\text{O}} \rightleftharpoons {\text{N}}{{\text{H}}_3} + {{\text{H}}_3}{{\text{O}}^ + }$. Phát biểu nào sau đây là đúng?
A. ${\text{N}}{{\text{H}}_4}{\;^ + }$là base.
B. ${\text{N}}{{\text{H}}_4}{\;^ + }$là acid.
C. ${{\text{H}}_2}{\text{O}}$ là acid.
D. ${{\text{H}}_3}{{\text{O}}^ + }$là base.
Câu 38. Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là một base?
A. ${\text{HCl}} + {{\text{H}}_2}{\text{O}} \to {{\text{H}}_3}{{\text{O}}^ + } + {\text{C}}{{\text{l}}^ – }$
B. ${\text{Ca}}{\left( {{\text{HC}}{{\text{O}}_3}} \right)_2} \to {\text{CaC}}{{\text{O}}_3} + {{\text{H}}_2}{\text{O}} + $ ${\text{C}}{{\text{O}}_2}$.
C. ${\text{N}}{{\text{H}}_3} + {{\text{H}}_2}{\text{O}} \rightleftharpoons {\text{NH}}_4^ + + {\text{O}}{{\text{H}}^ – }$.
D. ${\text{CuS}}{{\text{O}}_4} + 5{{\text{H}}_2}{\text{O}} \to {\text{CuS}}{{\text{O}}_4}.5{{\text{H}}_2}{\text{O}}$
Câu 39. Phân tử hay ion nào sau đây không có trong dung dịch ${\text{HCl}}$ ?
A. ${\text{HCl}}$
B. ${{\text{H}}^ + }$
C. ${\text{C}}{{\text{l}}^ – }$
D. ${{\text{H}}_2}{\text{O}}$
Câu 40. Phân tử hay ion nào sau đây không có trong dung dịch ${\text{NaOH}}$ ?
A. ${\text{N}}{{\text{a}}^ + }$
B. ${\text{O}}{{\text{H}}^ – }$
C. ${\text{NaOH}}$
D. ${{\text{H}}_3}{{\text{O}}^ + }$
Câu 41. Các ion tác dụng với nước tạo ra ${\text{H}} + $ được xem là:
A. Acid
B. Base
C. Lưỡng tính
D. Muối
Câu 42. Các ion tác dụng với nước tạo ra ion nào sau đây được xem là base?
A. ${{\text{H}}^ + }$
B. ${{\text{H}}_3}{{\text{O}}^ + }$
C. ${\text{O}}{{\text{H}}^ – }$
D. ${H_4}{O^{2 + }}$
Câu 43. Trong thực tế, ion ${\text{H}} + $ không tồn tại độc lập trong nước mà tạo thành?
A. ${\text{O}}{{\text{H}}^ – }$
B. ${{\text{H}}_2}{\text{O}}$
C. ${{\text{H}}_3}{{\text{O}}^ + }$
D. ${{\text{H}}_2}$
Câu 44. ${\text{HCl}} + {{\text{H}}_2}{\text{O}} \to {{\text{H}}_3}{{\text{O}}^ + } + {\text{C}}{{\text{l}}^ – }$được viết gọn lại là:
A. $2{{\text{H}}_2}{\text{O}} \to {{\text{H}}_3}{{\text{O}}^ + } + {\text{O}}{{\text{H}}^ – }$
B. ${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
C. ${\text{HCl}} + {{\text{H}}^ + } \to {{\text{H}}_2} + {\text{C}}{{\text{l}}^ – }$
D. $2{\text{HCl}} + {\text{O}}{{\text{H}}^ – } \to {{\text{H}}_3}{{\text{O}}^ + } + 2{\text{C}}{{\text{l}}^ – }$
Câu 45. Phương trình ion rút gọn của phản ứng cho biết:
A. Những ion nào tồn tại trong dung dịch
B. Nồng độ những ion nào tồn tại trong dung dịch lớn nhất
C. Bản chất của phản ứng trong dung dịch các chất điện li
D. Không tồn tại phân tử trong dung dịch các chất điện li
Câu 46. Một dung dịch có nồng độ $\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 2,5 \cdot {10^{ – 10}}{\text{mol}}/{\text{l}}$. Môi trường của dung dịch thu được có tính chất
A. Base.
B. Acid.
C. Trung tính.
D. Lưỡng tính.
Câu 47. Cho 4 dung dịch có cùng nồng độ mol là ${\text{NaCl}};{\text{C}}{{\text{H}}_3}{\text{COONaC}}{{\text{H}}_3}{\text{COOH}};{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$. Dung dịch có độ dẫn điện lớn nhất là
A. ${\text{NaCl}}$.
B. ${\text{C}}{{\text{H}}_3}{\text{COONa}}$.
C. ${\text{C}}{{\text{H}}_3}{\text{COOH}}$.
D. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$.
Câu 48. Cho hỗn hợp ${\text{Mg}}{\left( {{\text{Mn}}{{\text{O}}_4}} \right)_2},{\text{N}}{{\text{a}}_2}{\text{S}}{{\text{O}}_4},{{\text{K}}_2}{\text{C}}{{\text{r}}_2}{{\text{O}}_7}$ vào nước sẽ được dung dịch chưa các ion?
A. ${\text{M}}{{\text{g}}^{2 + }},{\text{Mn}}{{\text{O}}_4}{\;^{2 – }},{\text{N}}{{\text{a}}^ + },{\text{S}}{{\text{O}}_4}{\;^{2 – }},{{\text{K}}^ + },{\text{C}}{{\text{r}}_2}{{\text{O}}_7}{\;^{2 – }}$
B. ${\text{M}}{{\text{g}}^{2 + }},{\text{MnO}}_4^ – ,{\text{N}}{{\text{a}}^ + },{\text{SO}}_4^{2 – },{{\text{K}}^ + },{\text{C}}{{\text{r}}_2}{\text{O}}_7^{2 – }$
C. ${\text{M}}{{\text{g}}^{2 + }},{\text{Mn}}{{\text{O}}_4}{\;^{2 – }},{\text{N}}{{\text{a}}^ + },{\text{S}}{{\text{O}}_4}{\;^{2 – }},{{\text{K}}^ + },{\text{C}}{{\text{r}}_2}{{\text{O}}_7}{\;^{2 – }}$
D. ${\text{M}}{{\text{g}}^{2 + }},{\text{MnO}}_4^ – ,{\text{N}}{{\text{a}}^ + },{\text{S}}{{\text{O}}_4}{\;^{2 – }},{{\text{K}}^ + },{\text{C}}{{\text{r}}_2}{\text{O}}_7^{2 – }$
Câu 49. Dãy ion không thể tồn tại đồng thời trong dung dịch là
A. ${\text{N}}{{\text{a}}^ + },{\text{O}}{{\text{H}}^ – },{\text{M}}{{\text{g}}^{2 + }},{\text{NO}}_3^ – $
B. ${{\text{K}}^ + },{{\text{H}}^ + },{\text{C}}{{\text{l}}^ – },{\text{SO}}_4^{2 – }$
C. ${\text{HSO}}_3^ – ,{\text{M}}{{\text{g}}^ + },{\text{C}}{{\text{a}}^{2 + }},{\text{NO}}_3^ – $
D. ${\text{O}}{{\text{H}}^ – },{\text{N}}{{\text{a}}^ + },{\text{B}}{{\text{a}}^{2 + }},{\text{C}}{{\text{l}}^ – }$
Câu 50. Dãy gồm các chất điện li mạnh là
A. ${\text{NaCl}},{\text{Al}}{\left( {{\text{N}}{{\text{O}}_3}} \right)_3},{\text{Mg}}{({\text{OH}})_2}$
B. ${\text{NaCl}},{\text{Al}}{\left( {{\text{N}}{{\text{O}}_3}} \right)_3},{{\text{H}}_2}{\text{C}}{{\text{O}}_3}$
C. ${\text{NaCl}},{\text{Al}}{\left( {{\text{N}}{{\text{O}}_3}} \right)_3},{\text{HgC}}{{\text{l}}_2}$
D. ${\text{Ca}}{({\text{OH}})_2},{\text{BaS}}{{\text{O}}_4},{\text{AgCl}}$
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| A | B | A | A |
C |
|
6 |
7 | 8 | 9 | 10 |
| B | A | C | B |
B |
|
11 |
12 | 13 | 14 | 15 |
| B | B | C | A |
B |
|
16 |
17 | 18 | 19 |
20 |
|
B |
C | D | D | B |
| 21 | 22 | 23 | 24 |
25 |
|
B |
A | B | A | B |
| 26 | 27 | 28 | 29 |
30 |
|
C |
D | A | D | B |
| 31 | 32 | 33 | 34 |
35 |
|
D |
D | C | A | D |
| 36 | 37 | 38 | 39 |
40 |
|
B |
B | A | A | C |
| 41 | 42 | 43 | 44 |
45 |
|
A |
C | C | B | C |
| 46 | 47 | 48 | 49 |
50 |
|
B |
D | B | A |
D |








