Trắc nghiệm tổng hợp ammonia Hóa 11 có lời giải được soạn dưới dạng file word gồm 10 trang. Các bạn xem và tải về ở dưới.
I. KIẾN THỨC CƠ BẢN
Phương trình phản ứng: ${{\text{N}}_2}\left( {{\text{g}}} \right) + 3{{\text{H}}_2}\left( {{\text{g}}} \right) \leftrightharpoons 2{\text{N}}{{\text{H}}_3}\left( {{\text{g}}} \right)$
Phương pháp giải tổng quát
• Bước 1: Tính tỉ lệ mol của ${{\text{N}}_2}$ và ${{\text{H}}_2}$ trong hỗn hợp (nếu đề cho biết khối lượng mol trung bình của chúng). Từ đó suy ra số mol hoặc thể tích của ${{\text{N}}_2}$ và ${{\text{H}}_2}$ tham gia phản ứng. Nếu đề không cho số mol hay thể tích thì ta tự chọn lượng chất phản ứng đúng bằng tỉ lệ mol của ${{\text{N}}_2}$ và ${{\text{H}}_2}$.
• Bước 2: Căn cứ vào tỉ lệ mol của ${{\text{N}}_2}$ và ${{\text{H}}_2}$ để xác định xem hiệu suất tính theo chất nào (hiệu suất phản ứng tính theo chất thiếu trong phản ứng). Viết phương trình phản ứng căn cứ vào phương trình phản ứng suy ra số mol các chất đã phản ứng (nếu đề chưa cho biết số mol ${H_2}$ và ${{\text{N}}_2}$ phản ứng thì ta thường chọn số ${\text{mo}}{{\text{l}}_{\text{H}}}$ và ${{\text{N}}_2}$ phản ứng là $3{\text{x}}$ và ${\text{x}}$ ); số mol chất dư và số mol sản phẩm tạo thành.
• Bước 3: Tính tổng số mol hoặc thể tích khí trước và sau phản ứng. Lập biểu thức liên quan giữa số mol khí, áp suất, nhiệt độ của bình chứa trước và sau phản ứng (nếu đề cho biết thông tin về sự thay đổi áp suất). Từ đó suy ra các kết quả mà đề bài yêu cầu.
• Lưu ý: Mối quan hệ giữa số mol khí, áp suất và nhiệt độ khi thực hiện phản ứng trong bình kín có thể tích không đổi :
$\left\{ {\begin{array}{*{20}{l}}
{{n_1} = \frac{{{p_1}V}}{{R{T_1}}}} \\
{{n_2} = \frac{{{p_2}V}}{{R{T_2}}}}
\end{array} \Rightarrow \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}{T_2}}}{{{p_2}{T_1}}}} \right.$
Nếu ${{\text{T}}_2} = {{\text{T}}_1}$ thì suy ra $\frac{{{{\text{n}}_1}}}{{{{\text{n}}_2}}} = \frac{{{{\text{p}}_1}}}{{{{\text{p}}_2}}}$; Nếu ${{\text{T}}_2} = {{\text{T}}_1}$ và ${{\text{n}}_1} = {{\text{n}}_2}$ thì suy ra ${{\text{p}}_1} = {{\text{p}}_2}$.
Bài toán cho sã̃n hiệu suất
Tính hiệu suất phản ứng
• Tính toán bình thường, đến kết quả cuối cùng ta xem chất đang tính nếu:
• Trước mũi tên $\left( \to \right)$ chất tham gia phản ứng thì lấy: Kết quả.100/H.
• Sau mũi tên $\left( \to \right)$ chất tạo thành thì lấy: Kết quả.H/100.
• Bài toán cho hao hụt ${\text{a% }}$ thì xem hiệu suất là: $\left( {100 – {\mathbf{a}}} \right)$.
• Nếu bài toán có nhiều hiệu suất : ${\text{A}} \to {\text{BB}} \to \mathop {\text{C}}\limits^{\text{H}} {\text{C}}\left( {{{\text{H}}_1},{{\text{H}}_2}} \right.$ là hiệu suất phản ứng)
${{\text{m}}_{\text{A}}} = {\text{KQ}} \cdot \frac{{100}}{{{H_1}}} \cdot \frac{{100}}{{{H_2}}};{\text{}}{{\text{m}}_{\text{c}}} = {\text{KQ}} \cdot \frac{{{H_1}}}{{100}} \cdot \frac{{{H_2}}}{{100}}{\text{.}}$
• Trong bài toán có hiệu suất nhưng các chất cùng một bên thì không tính hiệu suất.
${\text{A}} + {\text{B}} \to {\text{C}} + {\text{D}}$
• Từ dữ liệu chất ${\text{A}}$ tính ra chất ${\text{B}}$ hoặc từ chất ${\text{C}}$ mà tính ra chất ${\text{D}}$ thì không xử lý hiệu suất. Từ dữ liệu chất ${\text{A}},{\text{B}}$ tính ra ${\text{C}},{\text{D}}$ hoặc ngược lại thì ta phải xử lý hiệu suất
Bài toán yêu cầu tính hiệu suất:
${\text{H% }} = \frac{{{\text{luongthucte}}}}{{{\text{luonglythuyet}}}} \cdot 100{\text{% }}$
Cho phản ứng tổng quát
${\text{aA}} + {\text{bB}} \to {\text{cC}} + {\text{dD}}$
$x\,\,\,\,\,\,\,\,y\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(mol)$
+ Nếu $\frac{x}{a} > \frac{y}{b}$$ \to $Hiệu suất tính theo B.
+ Nếu $\frac{x}{a} < \frac{y}{b}$$ \to $Hiệu suất tính theo A.
II. VÍ DỤ MINH HỌA
Câu 1. Trong bình kín dung tích không đổi chứa hỗn hợp khí ${\text{X}}$ gồm ${{\text{H}}_2}$ và ${{\text{N}}_2}$ (chất xúc tác thích hợp), áp suất trong bình là ${\text{p}}$ atm, tỉ khối của ${\text{X}}$ so với ${{\text{H}}_2}$ là 5 . Nung nóng bình để thực hiện phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$, rồi làm nguội bình về nhiệt độ ban đầu, thu được hỗn hợp khí ${\text{Y}}$, áp suất trong bình là $0,88{\text{p}}$ atm. Hiệu suất phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là
A. $26,0{\text{% }}$.
B. $19,5{\text{% }}$.
C. $24,0{\text{% }}$.
D. $20,0{\text{% }}$.
Lời giải
Hỗn hợp X: ( ${{\text{H}}_2}:{\text{a}}$ mol; ${{\text{N}}_2}:{\text{b}}$ mol), ${{\text{M}}_{\text{X}}} = 10$.
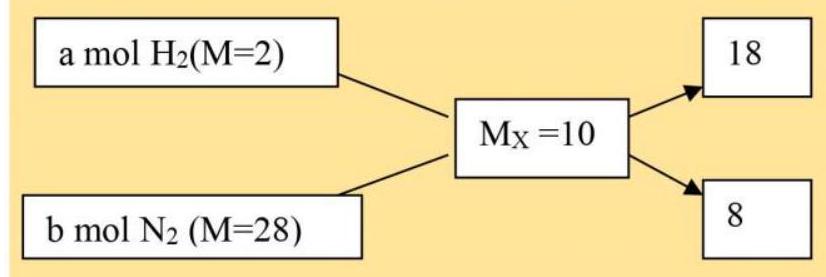
$ \to {\text{a}}/{\text{b}} = 18/8 = 9/4$
Giả sử ban đầu hỗn hợp khí ${\text{X}}$ bao gồm ${{\text{H}}_2}$$9{\text{mol}}$ và ${{\text{N}}_2}$$4{\text{mol}}$
$\frac{{{{\text{n}}_{\text{X}}}}}{{{{\text{n}}_{\text{Y}}}}} = \frac{{{{\text{p}}_{\text{X}}}}}{{{{\text{p}}_{\text{Y}}}}} \Rightarrow \frac{{13}}{{13 – 2x}} = \frac{1}{{0,88}} \Rightarrow x = 0,78{\text{}}H = \frac{{{n_{{H_2}pu}}}}{{{n_{{H_2}bd}}}} \cdot 100{\text{% }} = \frac{{3 \cdot 0,78}}{9} \cdot 100{\text{% }} = 26{\text{% }}$
$ \to $ Đáp án A.
Câu 2. Trong một bình kín chứa 10 lít nitrogen và 10 lít hydrogen ở nhiệt độ ${0^ \circ }{\text{C}}$ và $10{\text{atm}}$. Sau phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$, lại đưa bình về ${0^ \circ }{\text{C}}$. Biết rằng có $60{\text{% }}$ hydrogen tham gia phản ứng, áp suất trong bình sau phản ứng là :
A. $10{\text{atm}}$.
B. $8{\text{atm}}$.
C. $9{\text{atm}}$.
D. $8,5{\text{atm}}$.
Lời giải
Thể tích ${{\text{H}}_2}$ phản ứng là $10.60{\text{% }} = 6$ lít.
Phương trình phản ứng hoá học :

$\frac{{{{\text{V}}_1}}}{{{\text{}}{{\text{V}}_2}}} = \frac{{{{\text{n}}_1}}}{{{{\text{n}}_2}}} = \frac{{{{\text{p}}_1}}}{{{{\text{p}}_2}}} \Rightarrow \frac{{20}}{{16}} = \frac{{10}}{{{{\text{p}}_2}}} \Rightarrow {{\text{p}}_2} = 8{\text{atm}}$
$ \to $ Đáp án B.
Câu 3. Cho hỗn hợp gồm ${{\text{N}}_2},{{\text{H}}_2}$ và ${\text{N}}{{\text{H}}_3}$ có tỉ khối so với hydrogen là 8 . Dẫn hỗn hợp đi qua dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ đặc, dư thì thể tích khí còn lại một nửa. Thành phần phần trăm (%) theo thể tích của mỗi khí trong hỗn hợp lần lượt là:
A. $25{\text{% }}{{\text{N}}_2},25{\text{% }}{{\text{H}}_2}$ và $50{\text{% N}}{{\text{H}}_3}$.
B. $25{\text{% N}}{{\text{H}}_3},25{\text{% }}{{\text{H}}_2}$ và $50{\text{% }}{{\text{N}}_2}$.
C. $25{\text{% }}{{\text{N}}_2},25{\text{% N}}{{\text{H}}_3}$ và $50{\text{% }}{{\text{H}}_2}$.
D. $15{\text{% }}{{\text{N}}_2},35{\text{% }}{{\text{H}}_2}$ và $50{\text{% N}}{{\text{H}}_3}$.
Lời giải
Khi cho hỗn hợp gồm ${{\text{N}}_2},{{\text{H}}_2}$ và ${\text{N}}{{\text{H}}_3}$ đi qua dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ đặc, dư thì toàn bộ ${\text{N}}{{\text{H}}_3}$ bị hấp thụ. Theo giả thiết thì sau khi đi qua dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ đặc thì thể tích khí còn lại một nửa nên suy ra phần trăm về thể tích của ${\text{N}}{{\text{H}}_3}$ là $50{\text{% }}$, tổng phần trăm thể tích của ${{\text{N}}_2}$ và ${{\text{H}}_2}$ là $50{\text{% }}$.
${\overline M _{\left( {{{\text{N}}_2},{{\text{H}}_2},{\text{N}}{{\text{H}}_3}} \right)}} = \frac{{50.17 + 50 \cdot {{\overline M }_{\left( {{{\text{N}}_2},{{\text{H}}_2}} \right)}}}}{{100}} = 8.2 = 16$
$ \Rightarrow {\overline M _{\left( {{{\text{N}}_2},{{\text{H}}_2}} \right)}} = 15{\text{gam}}/{\text{mol}}$
Áp dụng sơ đồ đường chéo cho hỗn hợp ${{\text{N}}_2}$ và ${{\text{H}}_2}$ ta có:
Hỗn hợp X: ( ${{\text{H}}_2}$ : a mol; $\left. {{{\text{N}}_2}:{\text{bmol}}} \right),{{\text{M}}_{\text{X}}} = 15$.
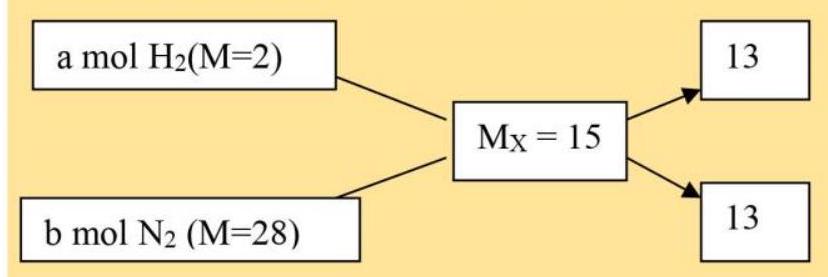
$ \to {\text{a}}/{\text{b}} = 13/13 = 1/1 \to {\text{% }}{{\text{N}}_2} = {\text{% }}{{\text{H}}_2} = 25{\text{% }}$.
$ \to $ Đáp án A.
Câu 4. Trong bình phản ứng có chứa hỗn hợp khí ${\text{A}}$ gồm $10{\text{mol}}{{\text{N}}_2}$ và $40{\text{mol}}{{\text{H}}_2}$ ở nhiệt đô ${0^ \circ }{\text{C}}$ và $10{\text{atm}}$. Sau khi phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$, lại đưa bình về ${0^ \circ }{\text{C}}$. Biết rằng có $60{\text{% }}$ hydrogen tham gia phản ứng
a. Tính số mol các khí trong bình sau phản ứng. b. Tính áp suất trong bình sau phản ứng.
Lời giải
a. Phương trình phản ứng:

Vậy số mol các khi trong bình sau phản ứng là: $4{\text{mol}}{{\text{N}}_2};16{\text{mol}}{{\text{H}}_2};12{\text{molN}}{{\text{H}}_3}$.
$2 + 16 + 16 = 34{\text{mol}}$
b. Tổng số mol khí trong bình ban đầu: $10 + 40 = 50{\text{mol}}$
Vì ${\text{PV}} = {\text{nRT}}$ mà ở đây thể tích và nhiệt độ không đổi, nên ta có:
${{\text{P}}_{\text{s}}}/{{\text{P}}_{\text{d}}} = {{\text{n}}_{\text{s}}}/{{\text{n}}_{\text{d}}} \to {{\text{p}}_{\text{s}}} = 34 \cdot 10/50 = 6,8{\text{atm}}$.
III. BÀl TẬP TRẮC NGHIỆM
Câu 1. Hỗn hợp khí ${\mathbf{X}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ có tỉ khối so với ${{\text{H}}_2}$ là 3,6. Nung nóng ${\mathbf{X}}$ một thời gian trong bình kín (có bột ${\text{Fe}}$ làm xúc tác), thu được hỗn hợp khí ${\mathbf{Y}}$ có tỉ khối đối với ${{\text{H}}_2}$ là 4 . Hiệu suất của phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là:
A. $36{\text{% }}$.
B. $25{\text{% }}$.
C. $50{\text{% }}$.
D. $40{\text{% }}$.
Câu 2. Cho vào bình kín $0,2{\text{mo}}{{\text{l}}_2}$ và $0,8{\text{mol}}{{\text{H}}_2}$ với xúc tác thích hợp. Sau một thời gian thấy tạo ra $0,3{\text{molNHN}}{{\text{H}}_3}$. Hiệu suất phản ứng được tổng hợp là:
A. $75{\text{% }}$
B. $56,25{\text{% }}$
C. $75,8{\text{% }}$
D. $64,25{\text{% }}$
Câu 3. Hỗn hợp ${\text{A}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ theo tỷ lệ thể tích $1:3$, tạo phản ứng giữa ${{\text{N}}_2}$ và ${{\text{H}}_2}$ sinh ${\text{r}}{{\text{a}}_3}$. Sau phản ứng được hỗn hợp khí ${\text{B}}$ có tỉ khối so với khí ${\text{A}}$ là 10/6. Hiệu suất phản ứng
A. $80{\text{% }}$
B. $50{\text{% }}$
C. $70{\text{% }}$
D. $85{\text{% }}$
Câu 4. Hỗn hợp khi ${\text{X}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ có tỉ khối hơi so với He bằng 1,8 . Đun nóng trong bình kín một thời gian (có bột ${\text{Fe}}$ làm xúc tác) thu được hỗn hợp khí ${\text{Y}}$ có tỉ khối hơi so với He bằng 2 . Hiệu suất phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là:
A. $10{\text{% }}$.
B. $20{\text{% }}$.
C. $25{\text{% }}$.
D. $5{\text{% }}$.
Câu 5. Cho vào bình kín $0,2{\text{mo}}{{\text{l}}_2}$ và $0,5{\text{mol}}{{\text{H}}_2}$ với xúc tác thích hợp. Sau một thời gian thấy tạo ra $0,2{\text{molN}}{{\text{H}}_3}$. Hiệu suất phản ứng được tổng hợp là:
A. $75{\text{% }}$
B. $56,25{\text{% }}$
C. $62,5{\text{% }}$
D. $60{\text{% }}$
Câu 6. Hỗn hợp ${\text{A}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ theo tỷ lệ thể tích $1:3$, tạo phản ứng giữa ${{\text{N}}_2}$ và ${{\text{H}}_2}$ sinh ${\text{r}}{{\text{a}}_3}$. Sau phản ứng được hỗn hợp khí ${\text{B}}$ có tỉ khối so với khí ${\text{A}}$ là 20/13. Hiệu suất phản ứng
A. $80{\text{% }}$
B. $50{\text{% }}$
C. $70{\text{% }}$
D. $85{\text{% }}$
Câu 7. Hỗn hợp khi ${\text{X}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơi so với He bằng 45/23. Hiệu suất phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là:
A. $10{\text{% }}$.
B. $20{\text{% }}$.
C. $25{\text{% }}$.
D. $5{\text{% }}$.
Câu 8. Hỗn hợp khí ${\mathbf{X}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ có tỉ khối so với ${{\text{H}}_2}$ là 6,2. Nung nóng ${\mathbf{X}}$ một thời gian trong bình kín (có bột ${\text{Fe}}$ làm xúc tác), thu được hỗn hợp khí ${\mathbf{Y}}$ có tỉ khối đối với ${{\text{H}}_2}$ là 620/21. Hiệu suất của phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là:
A. $36{\text{% }}$.
B. $25{\text{% }}$.
C. $50{\text{% }}$.
D. $40{\text{% }}$.
Câu 9. Trong bình dung tích không đổi chức hai hỗn hợp khí ${\text{X}}$ gồm ${{\text{H}}_2}$ và ${{\text{N}}_2}$ (chất xúc tác thích hợp), áp suất trong bình là ${\text{p}}$ atm, tỉ khối của ${\text{X}}$ so với ${{\text{H}}_2}$ là 3,6 . Nung nóng bình để thực hiện phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ rồi làm nguội bình về nhiệt độ ban đầu, thu được hỗn hợp khí ${\text{Y}}$, áp suất trong bình là $0,9{\text{p}}$ atm. Hiệu suất phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là
A. $18,75{\text{% }}$.
B. $20,00{\text{% }}$.
C. $22,50{\text{% }}$.
D. $25,00{\text{% }}$.
Câu 10. Hỗn hợp ${\text{X}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ có ${{\text{M}}_{{\text{TBX}}}} = 12$,4. Dẫn ${\text{X}}$ đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp ${\text{N}}{{\text{H}}_3}$ đạt $40{\text{% }}$ thì thu được hỗn hợp ${\text{Y}}$. ${{\text{M}}_{{\text{TBY}}}}$ có giá trị là:
A. 15,12 .
B. 18,23 .
C. 14,76 .
D. 13,48 .
Câu 11. Sau quá trình tổng hợp ${\text{N}}{{\text{H}}_3}$ từ ${{\text{H}}_2}$ và ${{\text{N}}_2}$ (tỉ lệ số mol là $3:1$ ), áp suất trong bình giảm đi $10{\text{% }}$ so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của ${{\text{N}}_2},{{\text{H}}_2},{\text{N}}{{\text{H}}_3}$ trong hỗn hợp khí thu được sau phản ứng lần lượt là:
A. $25{\text{% }};25{\text{% }};50{\text{% }}$.
B. $30{\text{% }};25{\text{% }};45{\text{% }}$.
C. $22,22{\text{% }};66,67{\text{% }};11,11{\text{% }}$.
D. $20{\text{% }};40{\text{% }};40{\text{% }}$.
Câu 12. Hỗn hợp khí ${\text{X}}$ gồm ${{\text{N}}_2}$ và ${{\text{H}}_2}$ có tỉ khối so với He bằng 1,8 . Đun nóng ${\text{X}}$ một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2 . Hiệu suất của phản ứng tổng hợp ${\text{N}}{{\text{H}}_3}$ là :
A. $50{\text{% }}$.
B. $36{\text{% }}$
C. $40{\text{% }}$.
D. $25{\text{% }}$.
Câu 13. Cho 2 lít ${{\text{N}}_2}$ và 7,5 lít ${{\text{H}}_2}$ vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 8,2 lít (các thể tích khí được đo trong cùng điều kiện). Hiệu suất phản ứng là bao nhiêu?
A. $20{\text{% }}$
B. $30{\text{% }}$
C. $15{\text{% }}$
D. $40{\text{% }}$
Câu 14. Nung một lượng ${\text{N}}{{\text{H}}_3}$ trong bình kín. Sau một thời gian đưa về nhiệt độ ban đầu thấy áp suất khí trong bình tăng 1,5 lần so với áp suất ban đầu. Tỉ lệ phần trăm lượng ${\text{N}}{{\text{H}}_3}$ bị phân hủy là
A. $25{\text{% }}$.
B. $33{\text{% }}$.
C. $50{\text{% }}$.
D. $67{\text{% }}$.
Câu 15. Cho hỗn hợp ${{\text{N}}_2}$ và ${{\text{H}}_2}$ vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm $5{\text{% }}$ so với áp suất ban đầu. Biết ti lệ số mol của nitơ đã phản ứng là $10{\text{% }}$. Thành phần phần trăm về số ${\text{mol}}$ của ${{\text{N}}_2}$ và ${{\text{H}}_2}$ trong hỗn hợp đầu là:
A. $15{\text{% }}$ và $85{\text{% }}$
B. $82,35{\text{% }}$ và $77,5{\text{% }}$
C. $25{\text{% }}$ và $75{\text{% }}$
D. $22,5{\text{% }}$ và $77,5{\text{% }}$.
ĐÁP ÁN
| 1 | 2 | 3 | 4 | 5 |
| B | A | A | C | D |
| 6 | 7 | 8 | 9 | 10 |
| C | B | D | D | C |
| 11 | 12 | 13 | 14 | 15 |
| C | D | A | C | C |
LỜI GIẢI
Câu 1.
Lời giải:
Phương trình hóa học: ${{\text{N}}_2} + 3{{\text{H}}_2} \leftrightharpoons 2{\text{N}}{{\text{H}}_3}$
Xét hỗn hợp X:
$\frac{{{{\text{n}}_{{{\text{N}}_2}}}}}{{{{\text{n}}_{{{\text{H}}_2}}}}} = \frac{{3,6.2 – 2}}{{28 – 3,6.2}} = \frac{1}{4} \to $ Hiệu suất tính theo ${{\text{N}}_2}$.
Giả sử ${{\text{n}}_{\text{X}}} = 5{\text{mol}} \to {{\text{n}}_{{{\text{H}}_2}}} = 4{\text{mol}};{{\text{n}}_{{{\text{N}}_2}}} = 1{\text{mol}}$ ${{\text{m}}_{\text{X}}} = {{\text{m}}_{\text{Y}}} \to {{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{X}}} = {{\text{M}}_{\text{Y}}}{{\text{n}}_{\text{Y}}} \to {{\text{n}}_{\text{Y}}} = 3,6 \cdot 2 \cdot 5/4 \cdot 2 = 4,5$
Gọi số mol nitrogen phản ứng là ${\text{x}}\left( {{\text{mol}}} \right)$
Ta có: $\left( {1 – x} \right) + \left( {4 – 3x} \right) + 2x = 4,5$
$ \to {\text{x}} = 0,25{\text{mol}} \to {\text{H}} = 25{\text{% }}$
Chọn B.
Câu 2.
Lời giải:

Nhận thấy : $0,2/1 < 0,8/3 \to $Hiệu suất theo ${{\text{N}}_2}$
$ \to {\text{H}} = 0,15/0,2 \cdot 100{\text{% }} = 75{\text{% }}$
Chọn A.
Câu 3.
Lời giải:
Đặt số ${\text{mol}}$ ban đầu của ${{\text{N}}_2}$ là $1{\text{mol}}$, vậy số ${\text{mol}}{{\text{H}}_2}$ là $3{\text{mol}}$.
Ta có:
${{\text{m}}_{\text{A}}} = {{\text{m}}_{\text{B}}} \to {{\text{M}}_{\text{A}}} \cdot {{\text{n}}_{\text{A}}} = {{\text{M}}_{\text{B}}} \cdot {{\text{n}}_{\text{B}}} \to {{\text{n}}_{\text{B}}} = \frac{{{{\text{M}}_{\text{A}}} \cdot {{\text{n}}_{\text{A}}}}}{{{{\text{M}}_{\text{B}}}}} = 0,6 \cdot 4 = 2,4{\text{mol}}$.
Đặt số ${\text{mol}}{{\text{N}}_2}$ phản ứng là ${\text{x}}$ mol, ta có:
${{\text{n}}_{\text{B}}} = \left( {1 – {\text{x}}} \right) + \left( {3 – 3{\text{x}}} \right) + 2{\text{x}} = 2,4 \to {\text{x}} = 0,8{\text{mol}}$
$ \to {\text{H}} = 80{\text{% }}$
Chọn A.
Câu 4.
Lời giải:
Áp dụng quy tắc đường chéo, ta tính được số ${\text{mol}}{{\text{H}}_2}$ gấp 4 lần số ${\text{mo}}{{\text{l}}_2}$.
Đặt số mol khí ban đầu là $5 \to $ số ${\text{mo}}{{\text{l}}_{\text{H}}}$ là 4 và số ${\text{mol}}{{\text{N}}_2}$ là 1
$ \to $ Hiệu xuất phản ứng tính theo số ${\text{mol}}{{\text{N}}_2}$
Ta có:
${{\text{M}}_{\text{X}}} = {{\text{m}}_{\text{Y}}} \to {{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{Y}}} = {{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{Y}}} \to {{\text{n}}_{\text{Y}}} = \frac{{{{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{X}}}}}{{{{\text{M}}_{\text{Y}}}}} = 0,9 \cdot 5 = 4,5{\text{mol}}$.
Đặt số ${\text{molN}}{{\text{N}}_2}$ phản ứng là ${\text{xmol}}$, ta có:
${{\text{n}}_{\text{Y}}} = \left( {1 – {\text{x}}} \right) + \left( {4 – 3{\text{x}}} \right) + 2{\text{x}} = 4,5 \to {\text{x}} = 0,25{\text{mol}}$
$ \to {\text{H}} = 25{\text{% }}$
Chọn C.
Câu 5.
Lời giải:
${{\text{N}}_2} + 3{{\text{H}}_2} \leftrightharpoons 2{\text{N}}{{\text{H}}_3}$
Trước phản ứng: ${\text{}}0,2{\text{}}0,5{\text{}}0$ Phản ứng: ${\text{}}0,1{\text{}}0,3{\text{}}0,2$
Sau phản ứng: ${\text{}}0,1{\text{}}0,2{\text{}}0,2$
Nhận thấy: $0,2/1 > 0,5/3 \to $ Hiệu suất tính theo ${{\text{H}}_2}$
$ \to {\text{H}} = 0,3/0,5 \cdot 100{\text{% }} = 60{\text{% }}$
Chọn D.
Câu 6.
Lời giải:
Đặt số ${\text{mol}}$ ban đầu của ${{\text{N}}_2}$ là $1{\text{mol}}$, vậy số ${\text{mol}}{{\text{H}}_2}$ là $3{\text{mol}}$.
Ta có:
${{\text{m}}_{\text{A}}} = {{\text{m}}_{\text{B}}} \to {{\text{M}}_{\text{A}}} \cdot {{\text{n}}_{\text{A}}} = {{\text{M}}_{\text{B}}} \cdot {{\text{n}}_{\text{B}}} \to {{\text{n}}_{\text{B}}} = \frac{{{{\text{M}}_{\text{A}}} \cdot {{\text{n}}_{\text{A}}}}}{{{{\text{M}}_{\text{B}}}}} = 0,65 \cdot 4 = 2,6{\text{mol}}$.
Đặt số ${\text{mol}}$${{\text{N}}_2}$ phản ứng là ${\text{x}}$ mol, ta có:
${{\text{n}}_{\text{B}}} = \left( {1 – {\text{x}}} \right) + \left( {3 – 3{\text{x}}} \right) + 2{\text{x}} = 2,6 \to {\text{x}} = 0,7{\text{mol}}$
$ \to {\text{H}} = 70{\text{% }}$
Chọn C.
Câu 7.
Lời giải:
Áp dụng quy tắc đường chéo, ta tính được số ${\text{mol}}{{\text{H}}_2}$ gấp 4 lần số ${\text{mol}}{{\text{N}}_2}$.
Đặt số mol khí ban đầu là $5 \to $ số ${\text{mo}}{{\text{l}}_{\text{H}}}$ là 4 và số ${\text{mol}}{{\text{N}}_2}$ là 1
$ \to $ Hiệu xuất phản ứng tính theo số ${\text{mol}}{{\text{N}}_2}$
Ta có:
${{\text{M}}_{\text{X}}} = {{\text{m}}_{\text{Y}}} \to {{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{Y}}} = {{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{Y}}}$
$ \to {{\text{n}}_{\text{Y}}} = \frac{{{{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{X}}}}}{{{{\text{M}}_{\text{Y}}}}} = 0,92 \cdot 5 = 4,6{\text{mol}}$.
Đặt số ${\text{molN}}{{\text{N}}_2}$ phản ứng là ${\text{x}}$ mol, ta có:
${{\text{n}}_{\text{Y}}} = \left( {1 – {\text{x}}} \right) + \left( {4 – 3{\text{x}}} \right) + 2{\text{x}} = 4,6 \to {\text{x}} = 0,2{\text{mol}}$
$ \to {\text{H}} = 20{\text{% }}$
Chọn B.
Câu 8.
Lời giải:
Phương trình hóa học:
${{\text{N}}_2} + 3{{\text{H}}_2} \leftrightharpoons 2{\text{N}}{{\text{H}}_3}$
Xét hỗn hợp ${\text{X}}$ :
$\frac{{{{\text{n}}_{{{\text{N}}_2}}}}}{{{{\text{n}}_{{{\text{H}}_2}}}}} = \frac{{6,2.2 – 2}}{{28 – 6,2.2}} = \frac{2}{3} \to $ Hiệu suất tính theo ${{\text{H}}_2}$.
Giả sử ${{\text{n}}_{\text{X}}} = 5{\text{mol}} \to {{\text{n}}_{{{\text{H}}_2}}} = 3{\text{mol}};{{\text{n}}_{{{\text{N}}_2}}} = 2{\text{mol}}$
${{\text{m}}_{\text{X}}} = {{\text{m}}_{\text{Y}}} \to {{\text{M}}_{\text{X}}} \cdot {{\text{n}}_{\text{X}}} = {{\text{M}}_{\text{Y}}}{{\text{n}}_{\text{Y}}} \to {{\text{n}}_{\text{Y}}} = 6,2 \cdot 2 \cdot 5/4 \cdot 2 = 4,2$
Gọi số mol nitrogen phản ứng là ${\text{x}}\left( {{\text{mol}}} \right)$
Ta có: $\left( {2 – x} \right) + \left( {3 – 3x} \right) + 2x = 4,2$ $ \to {\text{x}} = 0,4{\text{mol}} \to {\text{H}} = 40{\text{% }}$
Chọn D.
Câu 9.
Lời giải:
Hỗn hợp X: ( ${{\text{H}}_2}$ : a mol; ${{\text{N}}_2}$ : b mol), ${{\text{M}}_{\text{X}}} = 3,6.2 = 7,2$
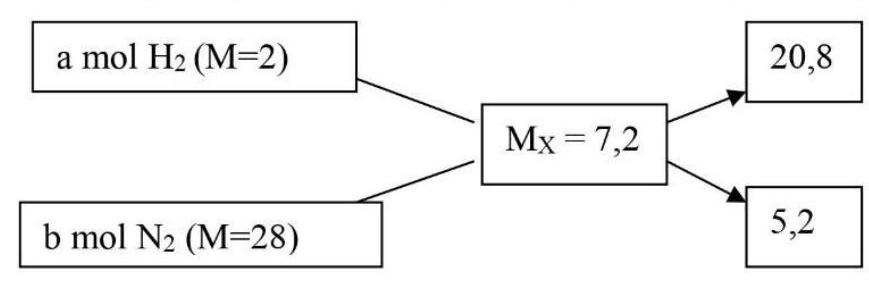
$ \to {\text{a}}/{\text{b}} = 20,8/5,2 = 4/1$
Vậy $X:{{\text{H}}_2}4{\text{mol}}$ và ${{\text{N}}_2}1{\text{mol}}$
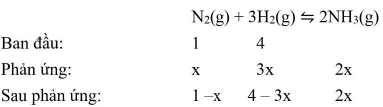
$\frac{{{{\text{n}}_{\text{X}}}}}{{{{\text{n}}_{\text{Y}}}}} = \frac{{{{\text{p}}_{\text{X}}}}}{{{{\text{p}}_{\text{Y}}}}} = > \frac{5}{{5 – 2{\text{x}}}} = \frac{1}{{0,9}} \to {\text{x}} = 0,25$
$ \to {\text{H}} = \frac{{{{\text{n}}_{{{\text{N}}_2}{\text{pu}}}}}}{{{{\text{n}}_{{{\text{N}}_2}{\text{bd}}}}}} \cdot 100{\text{% }} = \frac{{0,25}}{1} \cdot 100{\text{% }} = 25{\text{% }}$.
Chọn D.
Câu 10.
Lời giải:
Áp dụng sơ đồ đường chéo cho hỗn hợp ${{\text{N}}_2}$ và ${{\text{H}}_2}$ ta có :
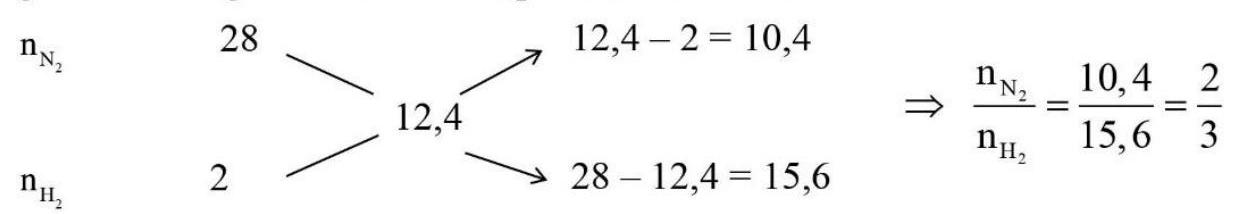
Với tỉ lệ trên suy ra ${{\text{H}}_2}$ thiếu, hiệu suất phản ứng tính theo ${{\text{H}}_2}$.
Trong hỗn hợp $X$ ta chọn $\left\{ {\begin{array}{*{20}{l}}
{{{\text{n}}_{{{\text{N}}_2}}} = 2{\text{mol}}} \\
{{{\text{n}}_{{{\text{H}}_2}}} = 3{\text{mol}}}
\end{array}} \right.$
 ${{\text{m}}_{\text{Y}}} = {{\text{m}}_{\text{X}}} = {{\text{m}}_{{{\text{N}}_2}}} + {{\text{m}}_{{{\text{H}}_2}}} = 2.28 + 3.2 = 62$ gam.
${{\text{m}}_{\text{Y}}} = {{\text{m}}_{\text{X}}} = {{\text{m}}_{{{\text{N}}_2}}} + {{\text{m}}_{{{\text{H}}_2}}} = 2.28 + 3.2 = 62$ gam.
${{\text{n}}_{\text{Y}}} = 1,6 + 1,8 + 0,8 = 4,2 \Rightarrow {{\text{\bar M}}_{\text{Y}}} = \frac{{{{\text{m}}_{\text{Y}}}}}{{{{\text{n}}_{\text{Y}}}}} = \frac{{62}}{{4,2}} = 14,76$.
Chọn C.
Câu 11.
Lời giải:
Theo giả thiết, ta giả sử lúc đầu có $1{\text{mol}}{{\text{N}}_2}$ và $3{\text{mol}}{{\text{H}}_2}$.
Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí:
$\frac{{{{\text{n}}_1}}}{{{{\text{n}}_2}}} = \frac{{{{\text{p}}_1}}}{{{{\text{p}}_2}}} = \frac{{{{\text{p}}_1}}}{{90{\text{% }}{{\text{p}}_1}}}$$ \Rightarrow {\text{n}}$hỗn hợp khí sau phản ứng $ = {{\text{n}}_2} = 4 \cdot \frac{{90}}{{100}} = 3,6{\text{mol}}$
Theo (1) ta thấy :
Số mol hỗn hợp khí sau phản ứng bằng $\left( {1 – {\text{x}}} \right) + \left( {3 – 3{\text{x}}} \right) + 2{\text{x}} = 4 – 2{\text{x}} = 3,6 \to {\text{x}} = 0,2$
Vậy phần trăm về thể tích của các khí là :
${\text{% }}{{\text{V}}_{{{\text{N}}_2}}} = \frac{{1 – 0,2}}{{3,6}} \cdot 100 = 22,22{\text{% }};{\text{}}$
${\text{% }}{{\text{V}}_{{{\text{H}}_2}}} = \frac{{3 – 3 \cdot 0,2}}{{3,6}} \cdot 100 = 66,67{\text{% }};$
${\text{% }}{{\text{V}}_{{\text{N}}{{\text{H}}_3}}} = 11,11{\text{% }}$
Chọn C.
Câu 12.
Lời giải:
Áp dụng sơ đồ đường chéo cho hỗn hợp ${{\text{N}}_2}$ và ${{\text{H}}_2}$ ta có :
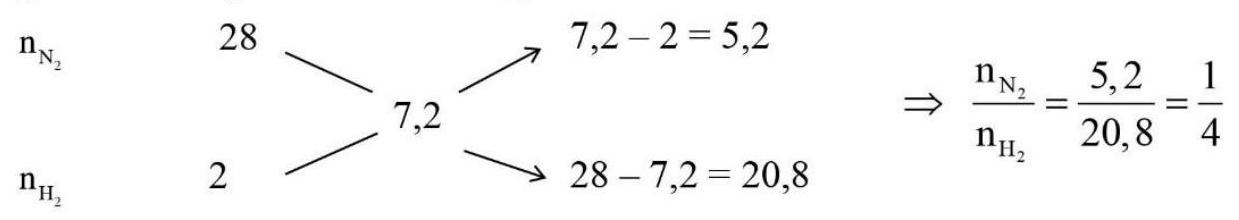
Chọn ${{\text{n}}_{{{\text{N}}_2}}} = 1{\text{mol}};{{\text{n}}_{{{\text{H}}_2}}} = 4{\text{mol}}$.
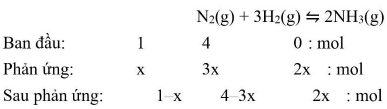
Theo (1) ta thấy :
Số mol hỗn hợp khí sau phản ứng $ = \left( {1 – x} \right) + \left( {4 – 3x} \right) + 2x = 5 – 2x$
Áp dụng định luật bảo toàn khối lượng ta có :
${{\text{m}}_{\text{X}}} = {{\text{m}}_{\text{Y}}} \to {{\text{n}}_{\text{X}}} \cdot {\overline M _{\text{X}}} = {{\text{n}}_{\text{Y}}} \cdot {\overline M _{\text{Y}}}$
$ \Leftrightarrow \frac{{{{\text{n}}_{\text{X}}}}}{{{{\text{n}}_{\text{Y}}}}} = \frac{{{{\overline M }_{\text{Y}}}}}{{{{\overline M }_{\text{X}}}}} = \frac{{2 \cdot 4}}{{1,8 \cdot 4}} = \frac{5}{{5 – 2{\text{x}}}} \Rightarrow {\text{x}} = 0,25$.
Hiệu suất phản ứng tính theo ${{\text{N}}_2}$ vì ${{\text{H}}_2}$dư$:{\text{H}} = \frac{{0,25}}{1} \cdot 100{\text{% }} = 25{\text{% }}$
Chọn D.
Câu 13.
Lời giải:










tải file ở đâu v ạ
Bạn tải lại ở trên nhé.