- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 1 Sử Dụng Một Số Hóa Chất, Thiết Bị Cơ Bản Trong Phòng Thí Nghiệm
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 2 Phản Ứng Hoá Học
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 3 Mol Và Tỉ Khối Chất Khí
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 4 Dung Dịch Và Nồng Độ
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 5 Định Luật Bảo Toàn Khối Lượng Và Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 6 Tính Theo Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 7 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 8 Acid
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 9 Base Thang pH
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 10 Oxide
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 11 Muối
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 12 Phân Bón Hóa Học
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 13 Khối Lượng Riêng
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 15 Áp Suất Trên Một Bề Mặt
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 16 Áp Suất Chất Lỏng Áp Suất Khí Quyển
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 17 Lực Đẩy Archimedes
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 18 Tác Dụng Làm Quay Của Lực
- Chuyên Đề KHTN 8 Kết Nối Tri Thức Bài 19 Đòn Bẩy Và Ứng Dụng
Chuyên đề KHTN 8 Kết nối tri thức bài 6 Tính theo phương trình hoá học được soạn dưới dạng file word và PDF gồm 5 trang. Các bạn xem và tải về ở dưới.
BÀI 6: TÍNH THEO PHƯƠNG TRÌNH HOÁ HỌC
SGK KẾT NỐI TRI THỨC VỚI CUỘC SỐNG
A. TÓM TẮT LÝ THUYẾT
| 1. Tính lượng chất trong phương trình hóa học
Dựa vào phương trình hóa học, khi biết lượng một chất đã phản ứng hoặc lượng chất tạo thành, tính được lượng các chất còn lại. 2. Hiệu suất phản ứng a. Khái niệm hiệu suất phản ứng: – Xét phản ứng trong trường hợp tổng quát: Chất phản ứng → Sản phẩm – Với hiệu suất phản ứng nhỏ hơn 100% khi đó: + Lượng chất phản ứng dùng trên thực tế sẽ lớn hơn lượng tính theo phương trình hóa học (theo lí thuyết) + Lượng sản phẩm thu được trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hóa học b. Công thức tính hiệu suất phản ứng: $H = \frac{{m’}}{m}.100\% = \frac{{n’}}{n}.100\%$ Với: m,n lần lượt là khối lượng và số mol chất sản phẩm tính theo lí thuyết m’, n’ lần lượt là khối lượng và số mol chất sản phẩm tính theo thực tế |
B. CÂU HỎI TRONG BÀI HỌC
Câu 1: Hoà tan hết 0,65 gam Zn trong dung dịch HCl 1 M, phản ứng xảy ra như sau:
Zn + 2HCl → ZnCl2 + H2
Tính thể tích khí hydrogen thu được trong ví dụ trên ở 250C, 1 bar.
Hướng dẫn giải
${n_{Zn}} = \frac{{0,65}}{{65}} = 0,01$ (mol)
PTHH: Zn + 2HCl → ZnCl2 + H2
PTHH (mol) 1 1
Theo phản ứng (mol) 0,01 → 0,01
Thể tích khí hydrogen thu được ở 250C, 1 bar (tức điều kiện chuẩn) là:
${V_{{H_2}}} =$ 0,01 . 24,79 = 0,2479 lít.
Câu 2: Khi cho Mg tác dụng với dung dịch H2SO4 loãng thì xảy ra phản ứng hoá học như sau:
Mg + H2SO4 → MgSO4 + H2
Sau phản ứng thu được 0,02 mol MgSO4. Tính thể tích khí H2 thu được ở 250C, 1 bar.
Hướng dẫn giải
PTHH: Mg + H2SO4 → MgSO4 + H2
PTHH (Mol) 1 1
Phản ứng (mol) 0,02 → 0,02
Thể tích khí H2 thu được ở 250C, 1 bar (tức điều kiện chuẩn) là:
${V_{{H_2}}} =$ 0,02 . 24,79 = 0,4958 lít.
Câu 3: Khi nung nóng KClO3 xảy ra phản ứng hoá học sau (phản ứng nhiệt phân):
2KClO3$\xrightarrow{{{t^0}}}$ 2KCl + 3O2
Biết rằng hiệu suất phản ứng nhỏ hơn 100%.
Hãy chọn các từ/cụm từ (lớn hơn, nhỏ hơn, bằng) phù hợp với nội dung còn thiếu trong các câu sau đây:
– Khi nhiệt phân 1 mol KClO3 thì thu được số mol O2 … (1) … 1,5 mol.
– Để thu được 0,3 mol O2 thì cần số mol KClO3 … (2) … 0,2 mol.
Hướng dẫn giải
– Khi nhiệt phân 1 mol KClO3 thì thu được số mol O2 nhỏ hơn 1,5 mol.
– Để thu được 0,3 mol O2 thì cần số mol KClO3 lớn hơn 0,2 mol.
Câu 4: Nung 10 gam calcium carbonate (thành phần chính của đá vôi), thu được khí carbon dioxide và m gam vôi sống. Giả thiết hiệu suất phản ứng là 80%, xác định m.
Hướng dẫn giải
Số mol của CaCO3 : 0,1 mol
PTHH : CaCO3 $\xrightarrow{{{t^0}}}$CaO+ CO2
Theo PTHH (mol) 1 1
Theo phản ứng (mol) 0,1 0,1
Khối lượng CaO theo phương trình phản ứng là: 0,1.56=5,6 gam
Khối lượng CaO thực tế thu được là$\frac{{5,6.80}}{{100}} = 4,48$gam
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. CÂU TỰ LUẬN TƯƠNG TỰ
Câu 1: Khi cho m gam kim loại Mg phản ứng với ldung dịch HCl dư theo phản ứng:
Mg+ 2HCl → MgCl2 + H2 Sau phản ứng thu được 2,479 lít (đktc) khí hiđro ở 250C, 1 bar. Tính m?
Hướng dẫn giải
${n_{{H_2}}} = \frac{{2,479}}{{24,79}} = 0,1$ mol
PTHH: Mg+ 2HCl → MgCl2 + H2
PTHH (mol) 1 1
Phản ứng (mol) 0,1 ← 0,1
m= mMg= 0,1.24=2,4 gam
Câu 2: Khi cho kim loại 6,5g kim loại Zn phản ứng với dung dịch axit sunfuric loãng như sau: Zn+ H2SO4 →ZnSO4 + H2. Tính khối lượng muối ZnSO4 thu được sau phản ứng.
Hướng dẫn giải
Số mol kim loại Zn là nZn= 0,1 mol
PTHH Zn+ H2SO4 →ZnSO4 + H2
Theo PTHH (mol) 1 1
Theo phản ứng (mol) 0,1 → 0,1
${m_{ZnS{O_4}}} = 0,1.161 = 16,1$ gam
Câu 3: Nung 10 gam calcium carbonate (thành phần chính của đá vôi), thu được khí carbon dioxide và 4,48 gam vôi sống. Tính hiệu suất phản ứng ?
Hướng dẫn giải
PTHH: CaCO3$\xrightarrow{{{t^0}}}$CaO+ CO2
Theo PTHH (mol) 1 1
Theo phản ứng (mol) 0,1 0,1
Khối lượng của CaO lý thuyết là : mCaO LT = 0,1.56 = 5,6 gam
Hiệu suất phản ứng trên là
$H = \frac{{4,48.100}}{{5,6}} = 80\%$
Câu 4: Khí thiên nhiên nén (CNG – Compressed Natural Gas) có thành phần chính là methane (CH4), là nhiêu liệu sạch, thân thiện với môi trường. Xét phản ứng đốt cháy methane trong buồng đốt động cơ xe buýt sử dụng nhiên liệu CNG:
CH4 + 2O2 $\xrightarrow{{{t^0}}}$ CO2 + 2H2O
Tính thể tích khí CO2 (đkc) ở ở 250C, 1 bar từ 24,79 lít khí CH4
Hướng dẫn giải
PTHH: CH4 + 2O2 $\xrightarrow{{{t^0}}}$ CO2 + 2H2O
Theo PTHH (lit) 1 1
Theo phản ứng (lít) 24,79 24,79
Vậy ${V_{C{O_2}}} =$24,79 lít
Câu 5: Trong công nghiệp, xút (sodium hydroxide NaOH) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride (NaCl) có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine (Cl2)(sơ đồ minh họa).
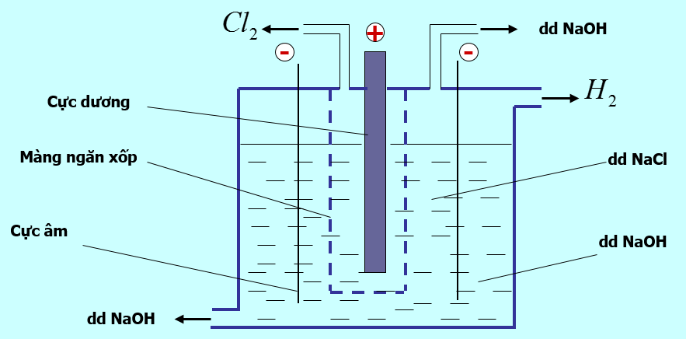
Chất khí này được làm khô (loại hơi nước) rồi hóa lỏng để làm nguyên liệu quan trong cho nhiều ngành công nghiệp chế biến và sản xuất hóa chất.
Từ quá trình điện phân nêu trên, một lượng chlorine (Cl2 )và hydrogen (H2) sinh ra được tận dụng để sản xuất hydrochloric acid HCl đặc thương phẩm (32%, D = 1,153 g/mL ở 30 ℃). Một nhà máy với quy mô sản xuất 200 tấn xút (NaOH) mỗi ngày thì đồng thời sản xuất được bao nhiêu m3 acid thương phẩm trên. Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất toàn bộ quá trình từ chlorine đến acid thương phẩm đạt 80% về khối lượng.
Hướng dẫn giải
2NaCl + 2H2O $\xrightarrow[{mn}]{{dpdd}}$ 2NaOH + Cl2 + H2
H2 + Cl2 $\xrightarrow{{}}$ 2HCl
$\xrightarrow{{PTHH}}{\text{ }}{{\text{n}}_{HCl}}{\text{ = }}{{\text{n}}_{NaOH}}{\text{ = }}\frac{{200}}{{40}}{\text{ }}\xrightarrow{{}}{\text{ }}{{\text{m}}_{HCl}}{\text{ = }}\frac{{200}}{{40}}.36,5.60\% .80\% $
$ \Rightarrow {\text{ }}{{\text{m}}_{dd(HCl)}}{\text{ = }}\frac{{\frac{{200}}{{40}}.36,5.60\% .80\% }}{{32\% }}{\text{ }} \Rightarrow {\text{ }}{{\text{V}}_{dd(HCl)}}{\text{ = }}\frac{m}{d} = \frac{{\frac{{200}}{{40}}.36,5.60\% .80\% }}{{32\% .}}{\text{ = 237, }}{{\text{m}}^3}$
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Cho phản ứng hóa học sau: Fe + 2HCl → FeCl2 + H2
Tỉ lệ số mol của Fe và H2 là
A. 1:1. B. 1:2. C. 2:1 D. 1:3.
Câu 2. Cho phương trình hóa học: CuO + H2SO4 → CuSO4 + H2O.Khi cho 1 mol CuO tác dụng với đủ với H2SO4 thu được x mol CuSO4 . Giá trị x là
A. 0,5 mol. B. 1 mol. C. 2 mol. D. 2,5 mol.
Câu 3. Chọn đáp án đúng: Công thức tính hiệu suất phản ứng theo chất sản phẩm là
A. $H = \frac{{{n_{LT}}}}{{{n_{TT}}}}.100\%$. B. $H = \frac{{{n_{TT}}}}{{{n_{LT}}}}.100\%$. C. $H = \frac{{{m_{LT}}}}{{{n_{TT}}}}.100\%$. D. $H = {m_{LT}}.{m_{TT}}.100\%$.
Câu 4. Cho phương trình hóa học : N2 + 3H2 → 2NH3
Tỉ lệ mol của các chất N2 :H2: NH3 lần lượt là
A. 1:2:3. B. 1:3:2. C. 2:1:3. D. 2:3:1.
Câu 5. Cho sơ đồ phản ứng : P + O2$\xrightarrow{{{t^0}}}$ P2O5
Tổng hệ số cân bằng của phản ứng trên là
A. 13 mol. B. 14 mol. C. 15 mol. D. 16 mol.
Câu 6. Hiệu suất phản ứng là
A. Tỉ lệ số mol giữa chất sản phẩm và chất tham gia phản ứng.
B. Tích số mol giữa chất sản phẩm và chất tham gia phản ứng.
C. Tỉ lệ giữa lượng sản phẩm thu được theo thực tế với lượng sản phẩm thu được theo lí thuyết.
D. Tỉ lệ giữa lượng chất tham gia phản ứng theo thực tế với lượng chất tham gia phản ứng theo lí thuyết.
Câu 7. Chọn phát biểu đúng
Khi hiệu suất phản ứng nhỏ hơn 100% thì
A. Lượng chất phản ứng dùng trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hóa học.
B. Lượng sản phẩm thu được trên thực tế sẽ lớn hơn lượng tính theo phương trình hóa học.
C. Lượng sản phẩm thu được trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hóa học.
D. Lượng sản phẩm thu được trên thực tế sẽ lớn hơn hoặc bằng lượng tính theo phương trình hóa học
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 1. Cho phương trình: $CaC{{\text{O}}_3}\xrightarrow{{{t^o}}}CaO + C{O_2}.$ Số mol CaCO3 cần dùng để điều chế được 11,2 gam Ca.
A. 0,2 mol. B. 0,3 mol. C. 0,4 mol. D. 0,1 mol.
Câu 2. Cho phương trình sau: $2KCl{O_3}\xrightarrow{{{t^o},\,\,xt}}2KCl + 3{O_2}.$ Giả sử phản ứng hoàn toàn, từ 0,6 mol KClO3 sẽ thu được bao nhiêu mol khí oxi?
A. 0,9 mol. B. 0,45 mol. C. 0,2 mol. D. 0,4 mol.
Câu 3. Cho phản ứng hóa học sau: $Al + {H_2}S{O_4}\xrightarrow{{}}A{l_2}{(S{O_4})_3} + {H_2}.$ Số mol H2SO4 phản ứng hết với 6 mol Al là
A. 6 mol. B. 9 mol. C. 3 mol. D. 5 mol.
Câu 4. Người ta điều chế vôi sống bằng cách nung đá vôi. Lượng vôi sống thu được từ 1 tấn đá vôi với hiệu suất phản ứng bằng 90% là
A. 0,252 tấn. B. 0,378 tấn. C. 0,504 tấn. D. 0,606 tấn.
Câu 5. Mg phản ứng với HCl theo phản ứng: $Mg + HCl\xrightarrow{{}}MgC{l_2} + {H_2}.$ Sau phản ứng thu được 2,479 lít (đktc) khí hiđro ở 250C và 1 bar thì khối lượng của Mg đã tham gia phản ứng là
A. 2,4 gam. B. 12 gam. C. 2,3 gam. D. 7,2am.
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 1. Đốt cháy hoàn toàn 7,5 gam than đá có chứa 4% tạp chất không cháy.
Thể tích khí oxi cần dùng (đktc) để đốt cháy hết lượng than đá trên ở 250C và 1 bar
là
A. 49,58 lít. B. 74,37 lít. C. 37,185 lít. D. 14,874 lít.
Hướng dẫn giải
PTHH: C+ O2$\xrightarrow{{{t^0}}}$ CO2
Theo bài, than đá có chứa 96% carbon.
Khối lượng cacbon là 7,5.96% = 7,2 gam
${n_C}$= 0,6 mol
Theo PTHH${n_{{O_2}}}$ =${n_C}$ = 0,6 mol
Thể tích khí oxi ở điều kiện chuẩn tại 250C và 1 bar là
${v_{{O_2}}}$= 0,6.24,79 = 14,847 lít
Câu 2. Quá trình quang hợp của cây xanh diễn ra theo sơ đồ phản ứng:
$6C{O_2} + 5{H_2}O\xrightarrow{{Diep\,\,luc,\,\,a\,s}}\underbrace {{{({C_6}{H_{10}}{O_5})}_n}}_{tinh\,\,bot} + 6{O_2} \uparrow $
Khối lượng tinh bột thu được nếu tiêu thụ 5 tấn nước và lượng khí CO2 tham gia phản ứng dư (hiệu suất phản ứng 80%) là
A. 9 tấn. B. 7,2 tấn. C. 11,25 tấn. D. 10 tấn.
Hướng dẫn giải
PTHH: $6C{O_2} + 5{H_2}O\xrightarrow{{Diep\,\,luc,\,\,a\,s}}\underbrace {{{({C_6}{H_{10}}{O_5})}_n}}_{tinh\,\,bot} + 6{O_2} \uparrow $
Theo PTHH 5.18 162
Theo phản ứng (tấn) 5 x
Suy ra x=$\frac{{5.162}}{{5.18}}$=9 tấn
Khối lượng thực tế tinh bột thu được là$\frac{{9.80}}{{100}} = 7,2$ tấn
Câu 3. Cho sơ đồ thí nghiệm điều chế khí oxygen như sau
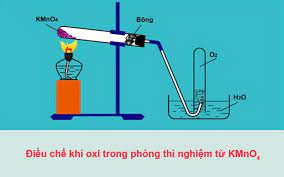
Khi phân huỷ hoàn toàn 47,4 gam KMnO4 phản ứng xảy ra như sau:
2KMnO4$\xrightarrow{{{t^0}}}$ K2MnO4 + MnO2 + O2
Thể tích khí oxygen thu được ở 250C và 1 bar là
A. 33,6 lít. B. 3,36 lít. C. 11,2 lít. D. 1,12 lít.
Hướng dẫn giải
${n_{KMn{O_4}}} = 0,3$
PTHH : 2KMnO4$\xrightarrow{{{t^0}}}$K2MnO4 +MnO2 +O2
Theo PTHH (mol) 2 1
Theo phản ứng (mol) 0,3 0,15
Thể tích khí oxygen thu được ở 250C và 1 bar là ${V_{{O_2}}} = 0,15.24,79 = 3,7185$lít









