- Đề Thi Học Kỳ 1 Hóa 11 Chân Trời Sáng Tạo Có Đáp Án-Đề 1
- Đề Kiểm Tra Học Kỳ 1 Hóa 11 Chân Trời Sáng Tạo Có Đáp Án-Đề 2
- Đề Kiểm Cuối Tra Học Kỳ 1 Hóa 11 Chân Trời Sáng Tạo Có Đáp Án-Đề 3
- Đề Thi Học Kỳ 1 Hóa 11 Cánh Diều Có Đáp Án-Đề 1
- Đề Cương Ôn Tập Học Kỳ 1 Hóa 11 Cánh Diều Theo Từng Chủ Đề
- Đề Kiểm Tra Học Kỳ 1 Hóa 11 Cánh Diều Có Đáp Án-Đề 2
- Đề Thi Học Kỳ 1 Hóa 11 Kết Nối Tri Thức Có Đáp Án-Đề 1
- Đề Kiểm Tra Học Kỳ 1 Hóa 11 Kết Nối Tri Thức Có Đáp Án-Đề 2
- Đề Cương Ôn Tập Học Kỳ 1 Hóa 11 Năm Học 2023-2024
- Đề Cương Ôn Tập Học Kỳ 1 Hóa 11 Kết Nối Tri Thức 2023-2024
- 400 Câu Trắc Nghiệm Ôn Tập Hóa 11 Học Kỳ 1 Năm 2023-2024 Theo Từng Mức Độ
- Tổng Hợp Các Kiến Thức Hóa 11 Học Kỳ 1 Năm Học 2023-2024
- Đề Thi HK1 Hóa 11 Sở GD Bắc Ninh 2023-2024 Có Đáp Án
Đề kiểm tra học kỳ 1 Hóa 11 Kết nối tri thức có đáp án-Đề 2 được soạn dưới dạng file word và PDF gồm 4 trang. Các bạn xem và tải về ở dưới.
I. PHẦN TRẮC NGHIỆM:
Câu 1. Chất thủy phân trong nước làm đổi màu giấy chỉ thị $pH$ là
A. $N{a_2}S{O_4}$.
B. $NaCl$.
C. $F{e_2}{\left( {S{O_4}} \right)_3}$.
D. ${C_{12}}{H_{22}}{O_{11}}$ (Saccharose).
Câu 2. Nhỏ vài giọt phenolphtalein vào dung dịch $N{H_3}$ thì dung dịch chuyển thành
A. màu xanh.
B. màu đỏ.
C. màu vàng.
D. màu hồng.
Câu 3. Cho Fe tác dụng với dung dịch $HN{O_3}$ đặc, nóng, thu được khí $X$ có màu nâu đỏ. Khí $X$ là
A. ${N_2}O$.
B. NO.
C. $N{O_2}$.
D. ${N_2}$.
Câu 4. Hợp chất $X$ có công thức đơn giản nhất là $C{H_3}O$. Vậy công thức phân tử của $X$ có thể là
A. ${C_2}{H_6}{O_2}$.
B. $C{H_3}O$.
C. ${C_2}{H_6}O$.
D. ${C_3}{H_9}{O_3}$.
Câu 5. Để xác định phân tử khối của hợp chất hữu cơ, người ta sử dụng phổ khối lượng $MS$, trong đó phân tử khối của chất là giá trị $m/z$ của
A. peak $\left[ {{M^ + }} \right]$ lớn nhất.
B. peak $\left[ {{M^ + }} \right]$ nhỏ nhất.
C. peak có cường độ tín hiệu cao nhất.
D. nhóm peak xuất hiện nhiều lần nhất.
Câu 6. Căn cứ vào tính chất vật lí nào sau đây để tách ${N_2}$ ra khỏi không khí?
A. ${N_2}$ rất ít tan trong nước.
B. ${N_2}$ nhẹ hơn không khí.
C. ${N_2}$ là chất không màu, không mùi.
D. Nhiệt độ hóa lỏng của ${N_2}$ và ${O_2}$ là khác nhau.
Câu 7. Cho cân bằng hóa học: ${H_2}\left( {\;g} \right) + {F_2}\left( {\;g} \right) \rightleftharpoons 2HF\left( g \right),\,{\Delta _r}H < 0$. Biểu thức tính hằng số cân bằng ${K_C}$ là
A. ${K_C} = \frac{{\left[ {HF} \right]}}{{\left[ {{H_2}} \right] \cdot \left[ {{F_2}} \right]}}$
B. ${K_C} = \frac{{{{[HF]}^2}}}{{\left[ {{H_2}} \right] \cdot \left[ {{F_2}} \right]}}$.
C. ${K_C} = \frac{{\left[ {HF} \right]}}{{\left[ {{H_2}} \right] \cdot \left[ {{F_2}} \right]}}$
D. ${K_C} = \frac{{\left[ {{H_2}} \right]\left[ {{F_2}} \right]}}{{{{[HF]}^2}}}$
Câu 8. Cho cân bằng hoá học: ${N_2}\left( {\;g} \right) + 3{H_2}\left( {\;g} \right)\mathop \rightleftarrows \limits^{xt{t^ \circ }} 2N{H_3}\left( {\;g} \right)$; phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi nồng độ ${N_2}$.
B. thay đổi nhiệt độ.
C. thêm chất xúc tác Fe.
D. thay đổi áp suất của hệ.
Câu 9. Nhôm không bị hòa tan trong dung dịch
A. $HCl$
B. ${H_2}S{O_4}$ loãng
C. $HN{O_3}$ loãng
D. $HN{O_3}$ đặc nguội
Câu 10. Dùng phương pháp sắc kí để tách $A$ và $B,A$ ra khỏi cột trước, $B$ ra sau. Phát biểu nào sau đây đúng?
A. A và $B$ không tan trong pha động.
B. B bị hấp phụ kém hơn $A$.
C. A hoà tan tốt trong dung môi hơn $B$
D. $A$ và $B$ có cùng khả năng hấp phụ và hoà tan.
Câu 11. Pha loãng 1 lít dung dịch $NaOH$ có $pH = 9$ bằng nước để được dung dịch mới có $pH = 8$. Thể tích nước cần dùng là
A. 4 lít.
B. 9 lít.
C. 10 lít.
D. 5 lít.
Câu 12. Cho từng chất: $Fe,FeO,Fe{(OH)_2},Fe{(OH)_3},F{e_3}{O_4}$ lần lượt phản ứng với $HN{O_3}$ đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá – khử là
A. 2 .
B. 3 .
C. 5 .
D. 4.
Câu 13. Dãy chất nào sau đây là hợp chất hữu cơ ?
A. ${\left( {N{H_4}} \right)_2}C{O_3},C{O_2},C{H_4},{C_2}{H_6}$.
B. ${C_2}{H_4},C{H_4},{C_2}{H_6}O,{C_3}{H_9}\;N$.
C. $C{O_2},\;{K_2}C{O_3},NaHC{O_3},{C_2}{H_5}Cl$.
D. $N{H_4}HC{O_3},C{H_3}OH,C{H_4},CC{l_4}$.
Câu 14. Khi biết thành phần phần trăm của các nguyên tố và phân tử khối $M$ của hợp chất hữu cơ thì công thức tính số nguyên tử $C$ trong phân tử hữu cơ là
A. $\frac{{\% {m_C}}}{{12}} \times \frac{M}{{100}}$
B. $\frac{{\% {m_C}}}{{12}} \times \frac{m}{{100}}$
C. $\frac{{\% {m_C}}}{{14}} \times \frac{m}{{100}}$
D. $\frac{{\% {m_C}}}{{16}} \times \frac{M}{{100}}$
Câu 15. Cho phổ khối lượng của một hợp chất hữu cơ $A$ như hình vẽ:
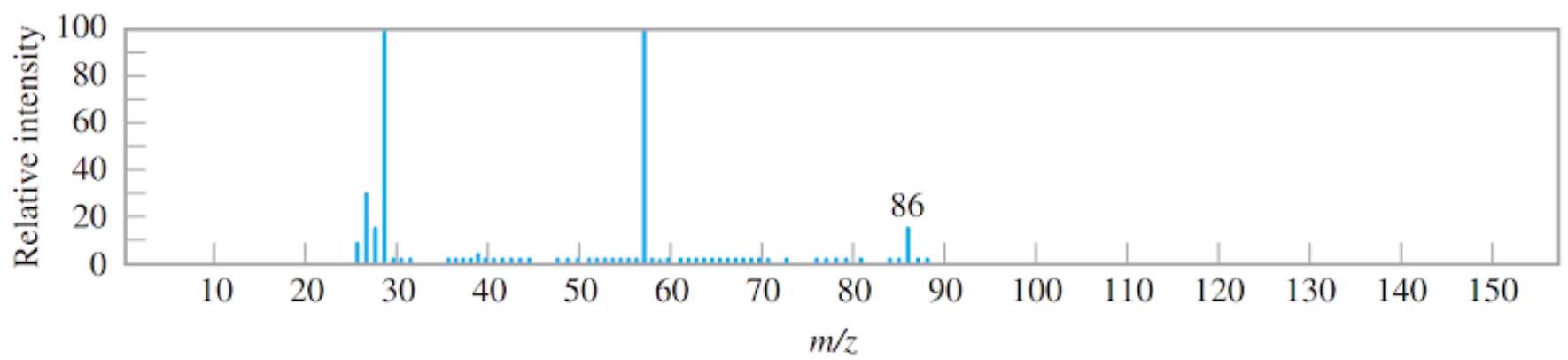
Hợp chất hữu cơ A có thể là
A. $C{H_2}C{l_2}$.
B. ${C_7}{H_8}$.
C. ${C_4}{H_8}{O_2}$.
D. ${C_4}{H_6}{O_2}$.
Câu 16. Một hydrocarbon $X$ ở thể khí có tỉ khối hơi so với hydrogen là 15 . Công thức phân tử của $X$ là
A. ${C_2}{H_6}$
B. $C{H_4}$
C. ${C_2}{H_4}$
D. ${C_2}{H_2}$
Câu 17. Phương trình hóa học của phản ứng nào sau đây chứng tỏ ammonia là một chất khử?
A. $N{H_3} + {H_2}O \rightleftarrows NH_4^ + + O{H^ – }$.
B. $2N{H_3} + {H_2}S{O_4} \to {\left( {N{H_4}} \right)_2}S{O_4}$.
C. $4N{H_3} + 5{O_2}\xrightarrow{{{t^0},Pt}}4NO + 6{H_2}O$.
D. $N{H_3} + HCl \to N{H_4}Cl$.
Câu 18. Oleum có công thức tổng quát là
A. ${H_2}S{O_4} \cdot nS{O_2}$.
B. ${H_2}S{O_4} \cdot n{H_2}O$.
C. ${H_2}S{O_4} \cdot nSOS{O_3}$.
D. ${H_2}S{O_4}$ đặc.
Câu 19. Cho dòng điện chạy qua dung dịch nước của một chất $\left( X \right)$ như thí nghiệm bên dưới, thấy đèn sáng tỏ:
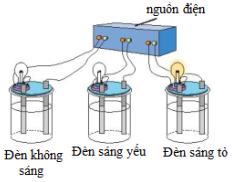
Cho các phát biểu sau:
(a) Dung dịch chất $\left( X \right)$ là chất điện li mạnh.
(b) Trong dung dịch $\left( X \right)$ có các ion dương và âm.
(c) Chất $\left( X \right)$ ở dạng rắn khan cũng dẫn điện.
(d) Dung dịch $\left( X \right)$ có thể là acid mạnh, base mạnh, muối tan.
Phát biểu không đúng là
A. (d).
B. (a).
C. (b).
D. (c).
Câu 20. Phân tích chất hữu cơ $X$ chứa $C,H,O$ ta có: ${n_C}:{n_H}:{n_O} = 1:3:1$. Công thức đơn giản nhất của $X$ là
A. ${C_6}{H_{12}}{O_4}$
B. $C{H_3}O$
C. ${C_3}{H_6}{O_2}$
D. ${C_3}{H_6}O$
Câu 21. Hợp chất nào dưới đây là hydrocarbon?
A. ${C_2}{H_5}Cl$
B. ${C_2}{H_5}COOC{H_3}$
C. $C{H_4}$
D. ${C_6}{H_5}OH$
Câu 22. Khí $X$ làm đục nước vôi trong và được dùng để làm chất tẩy trắng bột gỗ trong công nghiệp giấy. Chất X là
A. $S{O_2}$.
B. $N{H_3}$.
C. ${O_3}$.
D. $C{O_2}$.
Câu 23. Chọn phát biểu sai khi nói về phương pháp chưng cất:
A. Thành phần các chất khi bay hơi khác với thàn phần của chúng trong dung dịch.
B. Gồm 2 giai đoạn.
C. Là phương pháp tách và tinh chế đối với chất lỏng.
D. Chất nào có nhiệt độ sôi thấp sẽ chuyển thành hơi muộn hơn và ít hơn.
Câu 24. ${H_2}S{O_4}$ đặc, nguội không tác dụng được với tất cả các kim loại thuộc nhóm nào?
A. $Al,Mg,Fe$.
B. $Fe,Al,Cr$.
C. $Ag,Cu,Au$.
D. $Ag,Cu,Fe$.
Câu 25. Số oxi hóa cao nhất có thể có của sulfur trong các hợp chất là?
A. +6 .
B. +8 .
C. +4 .
D. +5 .
Câu 26. Kết quả phổ khối MS của acetone được cho trong bảng sau:
Phân tử khối của acetone là
| m/z | Cường độ tương đối (%) |
| 58 | 62 |
| 43 | 100 |
| 15 | 22 |
A. 58 .
B. 57 .
C. 59 .
D. 56 .
Câu 27. Một mẫu khí thải có chứa $C{O_2},N{O_2},\;{N_2}$ và $S{O_2}$ được sục vào dung dịch $Ca{(OH)_2}$ dư. Trong bốn khí đó, số khí bị hấp thụ là
A. 2 .
B. 3 .
C. 4 .
D. 1 .
Câu 28. Cho cân bằng (trong bình kín) sau:
$CO\left( g \right) + {H_2}O(g) \rightleftharpoons C{O_2}\left( {\;g} \right) + {H_2}\left( {\;g} \right)\,,\,\,(\Delta H < 0)$
Trong các yếu tố: (1) tăng nhiệt độ, (2) thêm 1 lượng hơi nước, (3) thêm 1 lượng ${H_2}$, (4) tăng áp suất chung của hệ, (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là
A. (2), (3), (4).
B. (1), (2), (3).
C. (1), (2), (4).
D. (1), (4), (5).
II. PHẦN TỰ LUẬN:
Câu 1.
Thành phần chính của tinh dầu chuối là ester $C{H_3}COOC{H_2}C{H_2}CH{\left( {C{H_3}} \right)_2}$, được điều chế từ phản ứng:
$C{H_3}COOH\left( {aq} \right) + {\left( {C{H_3}} \right)_2}CHC{H_2}C{H_2} – OH(aq) \rightleftharpoons C{H_3}COOC{H_2}C{H_2}CH{\left( {C{H_3}} \right)_2}\left( {aq} \right) + {H_2}O\left( l \right)$.
a) Để tăng hiệu suất phản ứng thì cần thay đổi nồng độ chất phản ứng như thế nào ?
b) Nếu ban đầu nồng độ $C{H_3}COOH$ là $0,1M;{\left( {C{H_3}} \right)_2}CHC{H_2}C{H_2}$ – $OH$ là $0,2M$ và tại thời điểm cân bằng nồng độ ester là $0,05M$ thì hằng số cân bằng ${K_C}$ bằng bao nhiêu ?
Câu 2.
Cho 7,437 lít nitrogen (đkc) phản ứng với hydrogen dư có chất xúc tác thích hợp một thời gian để điều chế ammonia. Tính thể tích ammonia thu được (đkc), biết hiệu suất phản ứng là $20\% $.
Câu 3.
Hai hợp chất ${\mathbf{X}}$ và ${\mathbf{Y}}$ có cùng công thức thực nghiệm là $C{H_2}O$. Phổ $MS$ cho thấy $X$ và $Y$ có các tín hiệu sau:
| Chất X | Chất Y | ||
| m/z | Cường độ tương đối (%) | m/z | Cường độ tương đối (%) |
| 29 | 19 | 31 | 100 |
| 31 | 100 | 59 | 50 |
| 60 | 38 | 90 | 16 |
Hai hợp chất X và Y có cùng công thức thực nghiệm là CH2O. Phổ MS cho thấy X và Y có các tín hiệu sau:
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| C | D | C | A | A | D | B |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| C | D | C | B | D | B | A |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| D | A | C | C | D | B | C |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| A | D | B | A | A | B | B |
II. PHẦN TỰ LUẬN
Câu 1.
a) Để tăng hiệu suất phản ứng ta tăng nồng độ acid $C{H_3}COOH$ hoặc alchohol ${\left( {C{H_3}} \right)_3}C{H^ – } – C{H_3} – C{H_3} – OH$
b)
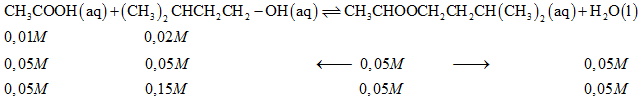
Ta có: $\;{K_c} = \frac{{\left[ {C{H_3}COOC{H_2}C{H_2}CH{{\left( {C{H_3}} \right)}_2}} \right] \cdot \left[ {{H_2}O} \right]}}{{\left[ {C{H_3}COOH} \right] \cdot \left[ {{{\left( {C{H_3}} \right)}_2}CHC{H_2}C{H_2}OH} \right]}} = \frac{{0,05 \cdot 0,05}}{{0,05 \cdot 0,15}} = 0,33$
Câu 2.
Ta có:
${n_{{N_2}\,bandau}} = 0.3\,mol$ mà $H = 20\% $
$\frac{{{n_{{N_2}\,phanung}}}}{{{n_{{N_2}\,bandau}}}}.100\% = 20\% \Leftrightarrow {n_{{N_2}\,phanung}} = 0,06\,(mol)$
Phương trình phản ứng

Vậy ${n_{N{H_3}}} = 0,12\,(mol) \Rightarrow {V_{N{H_3}}} = 2,9748\,L$
Câu 3.
KLPT của $X$ và $Y$ được xác định dựa vào tín hiệu peak phổ MS của mảnh $\left[ {{M^ + }} \right]$( có tỉ số $m/z$ lớn nhất $) \to {M_X} = 60$ và ${M_Y} = 90$
$X$ có công thức phân tử $\;\left( {C{H_2}O{)_n}} \right.$. Ta có: $\;30n = 60 \Rightarrow n = 2$
$ \Rightarrow $Công thức phân tử của ${\mathbf{X}}$ là $\;{C_2}{H_4}{O_2}$.
$Y$ có công thức phân tử $\;\left( {C{H_2}O{)_n}} \right.$. Ta có: $\;30n = 90 \Rightarrow n = 3$
Công thức phân tử của ${\mathbf{Y}}$ là $\;{C_3}{H_6}{O_3}$.








