- 10 Đề Thi Tốt Nghiệp THPT Môn Hóa 2024 Có Lời Giải Chi Tiết
- Đề KSCL Thi Tốt Nghiệp Môn Hóa 2024 THPT Đội Cấn Lần 2 Có Đáp Án
- Đề Thi Thử Tốt Nghiệp Môn Hóa 2024 Sở GD Bạc Liêu Lần 2 Có Đáp Án
- Đề Minh Họa Môn Hóa 2024 Thi Tốt Nghiệp THPT Bộ GD&ĐT Có Đáp Án
- Đề Thi Thử Tốt Nghiệp 2024 Môn Hóa Phát Triển Từ Đề Minh Họa Có Đáp Án-Đề 1
- Giải Chi Tiết Đề Tham Khảo Môn Hóa 2024 Tốt Nghiệp THPT Bộ GD&ĐT
- Đề Ôn Thi Tốt Nghiệp 2024 Môn Hóa Phát Triển Từ Đề Minh Họa Giải Chi Tiết-Đề 2
- Đề Luyện Thi Tốt Nghiệp 2024 Môn Hóa Phát Triển Từ Đề Minh Họa Giải Chi Tiết-Đề 3
- Đề Ôn Thi TN THPT 2024 Môn Hóa Phát Triển Từ Đề Minh Họa Giải Chi Tiết-Đề 4
- Đề Luyện Thi TN THPT 2024 Môn Hóa Bám Sát Đề Minh Họa Giải Chi Tiết-Đề 5
- Đề Luyện Thi Tốt Nghiệp Năm 2024 Môn Hóa Bám Sát Đề Minh Họa Giải Chi Tiết-Đề 6
- Đề Hóa Luyện Thi Tốt Nghiệp THPT 2024 Bám Sát Đề Minh Họa Giải Chi Tiết-Đề 7
- Đề Hóa Ôn Thi Tốt Nghiệp THPT 2024 Bám Sát Đề Minh Họa Giải Chi Tiết-Đề 8
- Đề Hóa Ôn Thi Tốt Nghiệp THPT 2024 Bám Sát Đề Minh Họa Giải Chi Tiết-Đề 9
- Đề Hóa Ôn Thi Tốt Nghiệp 2024 Bám Sát Đề Minh Họa Giải Chi Tiết-Đề 10
Giải chi tiết đề tham khảo môn Hóa tốt nghiệp THPT 2024 Bộ GD&ĐT được soạn dưới dạng file word và PDF gồm 9 trang. Các bạn xem và tải về ở dưới.
| BỘ GIÁO DỤC VÀ ĐÀO TẠO
ĐỀ THI THAM KHẢO (Đề thi có 04 trang) |
KỲ THI TỐT NGHIỆP TRUNG HỌC PHỔ THÔNG NĂM 2024 Bài thi: KHOA HỌC TỰ NHIÊN Môn thi thành phần: HÓA HỌC Thời gian làm bài: 50 phút, không kể thời gian phát đề |
Cho nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; Br = 80; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; I = 127; Ba = 137.
Câu 41: Polime nào sau đây thuộc loại polime thiên nhiên?
A. Poliacrilonitrin. B. Polietilen. C. Poli(vinyl clorua). D. Xenlulozơ.
Câu 42: Công thức của crom(III) sunfat là
A. Cr2O3. B. CrCl3. C. Cr2(SO4)3. D. CrSO4.
Câu 43: CaCO3 tinh khiết được dùng làm chất độn trong một số ngành công nghiệp. Tên của CaCO3 là
A. canxi hiđrocacbonat. B. canxi sunfat.
C. canxi clorua. D. canxi cacbonat.
Câu 44: Phân tử khối của etyl axetat là
A. 86. B. 60. C. 74. D. 88.
Câu 45: Kim loại Al tác dụng với dung dịch NaOH sinh ra khí nào sau đây?
A. O3. B. N2. C. H2. D. O2.
Câu 46: Chất nào sau đây không phản ứng với dung dịch HCl?
A. NaCl. B. Na2CO3. C. NaOH. D. Ca(OH)2.
Câu 47: Số nguyên tử cacbon trong phân tử Gly–Ala là
A. 7. B. 5. C. 4. D. 6.
Câu 48: Chất nào sau đây là nguyên liệu để sản xuất tơ visco?
A. Saccarozơ. B. Tinh bột. C. Glucozơ. D. Xenlulozơ.
Câu 49: Khi đun nóng, sắt tác dụng với lưu huỳnh sinh ra hợp chất trong đó sắt có số oxi hoá là
A. -3. B. +2. C. +3. D. -2.
Câu 50: Kim loại nào sau đây tác dụng với nước tạo thành dung dịch kiềm?
A. Fe. B. Ag. C. Na. D. Cu.
Câu 51: Khí CO là một trong những chất gây ô nhiễm môi trường, có trong khí núi lửa, khí lò cao, khí thải của các phương tiện giao thông. Tên của CO là
A. cacbon monooxit. B. cacbon tetraclorua. C. cacbon đioxit. D. cacbon đisunfua.
Câu 52: Để bảo vệ ống thép dẫn dầu bằng phương pháp điện hoá cần gắn vào mặt ngoài của ống những khối kim loại nào sau đây?
A. Zn. B. Pb. C. Ag. D. Cu.
Câu 53: Chất nào sau đây là ancol?
A. C2H5OH. B. CH3COOCH3. C. CH3CHO. D. CH3COOH.
Câu 54: Natri hiđroxit là hóa chất quan trọng, đứng hàng thứ hai sau axit sunfuric. Công thức của natri hiđroxit là
A. NaCl. B. Ca(OH)2. C. NaOH. D. Al(OH)3.
Câu 55: Nhỏ từ từ đến dư dung dịch chất nào sau đây vào ống nghiệm đựng dung dịch AlCl3 thu được kết tủa keo, màu trắng?
A. H2SO4. B. HCl. C. NaCl. D. NH3.
Câu 56: Kim loại nào sau đây có khối lượng riêng lớn nhất?
A. Ca. B. Li. C. Na. D. Os.
Câu 57: Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các ion nào sau đây?
A. Na+, Cl–. B. Li+, Cl–. C. K+, Na+. D. Ca2+, Mg2+.
Câu 58: Trong công nghiệp, Al được điều chế trực tiếp từ Al2O3 bằng phương pháp nào sau đây?
A. Điện phân dung dịch. B. Nhiệt luyện.
C. Điện phân nóng chảy. D. Thuỷ luyện.
Câu 59: Chất nào sau đây thuộc loại amin bậc một?
A. Triolein. B. Trimetylamin. C. Đimetylamin. D. Metylamin.
Câu 60: Số nguyên tử hiđro trong phân tử axit oleic là
A. 33. B. 34. C. 35. D. 36.
Câu 61: Phát biểu nào sau đây đúng?
A. Kim loại Fe tan trong H2SO4 đặc, nguội.
B. Kim loại Fe phản ứng với HCl trong dung dịch sinh ra FeCl2.
C. Fe2O3 phản ứng với dung dịch HNO3 sinh ra Fe(NO3)2.
D. Trong các phản ứng hóa học, ion Fe2+ chỉ thể hiện tính khử.
Câu 62: Lên men 180 gam glucozơ, thu được m gam ancol etylic. Biết hiệu suất của phản ứng lên men là 70%. Giá trị của m là
A. 82,8. B. 92,0. C. 64,4. D. 46,0.
Câu 63: Hiđro hóa hoàn toàn 17,68 gam triolein cần vừa đủ b mol H2. Giá trị của b là
A. 0,02. B. 0,06. C. 0,12. D. 0,18.
Câu 64: Phát biểu nào sau đây đúng?
A. Dung dịch saccarozơ có phản ứng tráng bạc. B. Tinh bột và xenlulozơ là đồng phân của nhau.
C. Saccarozơ thuộc loại polisaccarit. D. Glucozơ là hợp chất hữu cơ tạp chức.
Câu 65: Cho bốn dung dịch sau: Na2CO3, KCl, FeSO4, HCl. Số dung dịch tác dụng với lượng dư dung dịch Ba(OH)2 thu được kết tủa là
A. 3. B. 2. C. 1. D. 4.
Câu 66: Cho 16,8 gam muối cacbonat của kim loại M (hóa trị II) vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch chứa 19 gam muối. Kim loại M là
A. Ca. B. Mg. C. Zn. D. Fe.
Câu 67: Đốt cháy hoàn toàn amin đơn chức X, thu được N2; 1,05 mol H2O và 0,6 mol CO2. Công thức phân tử của X là
A. C3H9N. B. CH5N. C. C2H7N. D. C4H11N.
Câu 68: Phát biểu nào sau đây đúng?
A. Trùng ngưng buta-1,3-đien thu được polime dùng để sản xuất cao su buna.
B. Đồng trùng hợp buta-1,3-đien và acrilonitrin thu được polime dùng để sản xuất cao su buna–N.
C. Trùng ngưng buta-1,3-đien và stiren thu được polime dùng để sản xuất cao su buna–S.
D. Trùng hợp buta-1,3-đien và lưu huỳnh thu được polime dùng để sản xuất cao su buna–S.
Câu 69: Cho 6,4 gam kim loại Cu tác dụng hết với dung dịch H2SO4 (đặc, nóng, dư) sinh ra y mol SO2 (sản phẩm khử duy nhất). Giá trị của y là
A. 0,15. B. 0,10. C. 0,20. D. 0,05.
Câu 70: Cho sơ đồ chuyển hóa sau:
$X\left( {{C_4}{H_8}{O_2}} \right)\xrightarrow{{NaOH,{t^\circ }}}$ ancol $Y\xrightarrow{{{O_2} (men\, giấm) }}C{H_3}COOH$
Công thức của X là
A. HCOOCH2CH2CH3. B. C2H5COOCH3.
C. CH3COOC2H5. D. CH3CH2CH2COOH.
Câu 71: Chất hữu cơ X có công thức là C3H10O2N2. Cho X tác dụng với dung dịch NaOH thu được khí Y và chất Z là muối của amino axit T. Cho các phát biểu sau:
(a) Dung dịch chất T không làm đổi màu quỳ tím.
(b) 1 mol X phản ứng được với tối đa 2 mol NaOH trong dung dịch.
(c) Y tan tốt trong nước tạo thành dung dịch có pH < 7.
(d) Ở điều kiện thường, T là chất rắn và dễ tan trong nước.
(đ) Y có hai nguyên tử nitơ trong phân tử.
Số phát biểu sai là :
A. 4. B. 2. C. 1. D. 3.
 Câu 72: Một vết nứt trên đường ray tàu hỏa có thể tích 6,72 cm³. Dùng hỗn hợp tecmit (Al và Fe2O3 theo tỉ lệ mol tương ứng 2 : 1) để hàn vết nứt trên. Biết: lượng Fe cần hàn cho vết nứt bằng 79% lượng Fe sinh ra; khối lượng riêng của sắt là 7,9 gam/cm³; chỉ xảy ra phản ứng khử Fe2O3 thành Fe với hiệu suất của phản ứng bằng 96%. Khối lượng của hỗn hợp tecmit tối thiểu cần dùng là :
Câu 72: Một vết nứt trên đường ray tàu hỏa có thể tích 6,72 cm³. Dùng hỗn hợp tecmit (Al và Fe2O3 theo tỉ lệ mol tương ứng 2 : 1) để hàn vết nứt trên. Biết: lượng Fe cần hàn cho vết nứt bằng 79% lượng Fe sinh ra; khối lượng riêng của sắt là 7,9 gam/cm³; chỉ xảy ra phản ứng khử Fe2O3 thành Fe với hiệu suất của phản ứng bằng 96%. Khối lượng của hỗn hợp tecmit tối thiểu cần dùng là :
A. 116,88 gam. B. 133,75 gam.
C. 105,66 gam. D. 128,40 gam.
Câu 73: Thực hiện thí nghiệm theo các bước sau:
• Bước 1: Rót vào hai ống nghiệm đã được đánh số (1) và (2), mỗi ống nghiệm 6 ml dung dịch H2SO4 5%.
• Bước 2: Cho vào mỗi ống nghiệm một thanh Zn.
• Bước 3: Nhỏ thêm 2–3 giọt dung dịch CuSO4 trong H2SO4 loãng vào ống nghiệm (2).
Cho các phát biểu sau:
(a) Trong bước 2, cả hai ống nghiệm đều xuất hiện bọt khí.
(b) Trong bước 2, Zn bị khử thành ion Zn2+ ở cả hai ống nghiệm.
(c) Trong bước 3, bọt khí thoát ra ở ống nghiệm (2) nhanh hơn ở ống nghiệm (1).
(d) Trong bước 3, ở ống nghiệm (2) có một lượng nhỏ kim loại Cu bám vào thanh Zn.
(đ) Trong bước 3, Zn bị ăn mòn điện hóa học ở cả hai ống nghiệm.
Số phát biểu đúng là :
A. 2. B. 4. C. 3. D. 1.
Câu 74: Hỗn hợp X gồm CuO, Fe, FeCO3, Fe2O3, Fe3O4. Cho a gam X tác dụng với dung dịch chứa 0,72 mol H2SO4 (dư 20% so với lượng phản ứng), thu được 0,15 mol hỗn hợp khí gồm CO2 và SO2 có tổng khối lượng là 8,6 gam. Mặt khác, hòa tan hết a gam X bằng dung dịch HCl, thu được dung dịch Y chỉ chứa muối và 0,07 mol hỗn hợp khí Z. Cho dung dịch AgNO3 dư vào Y, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa gồm Ag và AgCl. Biết SO2 là sản phẩm khử duy nhất của H2SO4. Giá trị của m là ?
A. 131,34. B. 129,92. C. 137,82. D. 120,54.
Câu 75: Hỗn hợp E gồm ba este đa chức, mạch hở X, Y, Z đều tạo bởi axit cacboxylic với ancol, trong E cacbon chiếm 44,984% về khối lượng; MX < MY < MZ < 234. Cho 18,14 gam E phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp hai ancol và 20,56 gam hỗn hợp muối khan T không có khả năng tham gia phản ứng tráng bạc. Phần trăm khối lượng các nguyên tố cacbon, hiđro trong T lần lượt là 23,346% và 1,751%. Khối lượng của Y trong 18,14 gam E là :
A. 2,92 gam. B. 4,72 gam. C. 2,36 gam. D. 4,38 gam.
Câu 76: Cho các phát biểu sau:
(a) Công thức phân tử của anilin là C3H7O2N.
(b) Số nguyên tử hiđro trong phân tử glucozơ là 12.
(c) Ở điều kiện thường, tất cả các este đều tan tốt trong nước.
(d) Dùng dung dịch AgNO3 trong NH3 phân biệt được hai dung dịch glucozơ và glixerol.
(đ) Tơ nitron bền với nhiệt và giữ nhiệt tốt nên được dùng để dệt vải may quần áo ấm.
Số phát biểu đúng là :
A. 2. B. 4. C. 5. D. 3.
Câu 77: Đốt cháy hoàn toàn m gam photpho trong oxi dư, thu được chất rắn X. Hoà tan hoàn toàn X trong 480 ml dung dịch Y (gồm NaOH và KOH) có pH = 13. Sau phản ứng, khối lượng chất tan trong dung dịch tăng 1,194 gam. Bỏ qua sự thủy phân của muối. Giá trị của m là :
A. 0,521. B. 1,491. C. 0,651. D. 1,488.
Câu 78: Điện phân dung dịch CuSO4 loãng với điện cực trơ, đến khi catot bắt đầu xuất hiện bọt khí thì dừng điện phân, thu được dung dịch X. Cho hỗn hợp Mg và Fe tác dụng với X, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y, khí Z và hỗn hợp chất rắn T.
Cho các phát biểu sau:
(a) Trong quá trình điện phân dung dịch CuSO4, khối lượng điện cực catot tăng.
(b) Số mol kim loại Cu sinh ra tại catot bằng số mol O2 sinh ra tại anot.
(c) Chất rắn T tan hoàn toàn trong lượng dư dung dịch sắt(III) sunfat.
(d) Dung dịch Y tác dụng với dung dịch NaOH dư, thu được kết tủa.
(đ) Dẫn khí Z qua ống chứa K2O đun nóng thu được kim loại K.
Số phát biểu đúng là :
A. 4. B. 2. C. 5. D. 3.
Câu 79: Soda (Na2CO3) được dùng trong công nghiệp thủy tinh, đồ gốm, bột giặt.

Làm lạnh 100 gam dung dịch Na2CO3 bão hòa ở 20°C đến khi thu được dung dịch bão hòa ở 10°C thì tách ra m gam tinh thể Na2CO3.10H2O. Biết 100 gam nước hòa tan được tối đa lượng Na2CO3 ở 20°C và 10°C lần lượt là 21,5 gam và 12,5 gam. Giá trị của m là ?
A. 7,41. B. 9,00. C. 28,60. D. 25,37.
Câu 80: Metyl salixylat dùng làm thuốc xoa bóp giảm đau, được điều chế theo phản ứng sau:
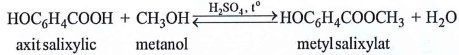
Để sản xuất 3,8 triệu tuýp thuốc xoa bóp giảm đau cần tối thiểu m tấn axit salixylic. Biết mỗi tuýp thuốc chứa 2,7 gam metyl salixylat và hiệu suất phản ứng tính theo axit salixylic là 75%. Giá trị của m là :
A. 9,315. B. 12,420. C. 6,986. D. 15,068.
ĐÁP ÁN VÀ GIẢI CHI TIẾT
| 41D | 42C | 43D | 44D | 45C |
| 46A | 47B | 48D | 49B | 50C |
| 51A | 52A | 53A | 54C | 55D |
| 56D | 57D | 58C | 59D | 60B |
| 61B | 62C | 63B | 64D | 65B |
| 66B | 67C | 68B | 69B | 70C |
| 71D | 72B | 73C | 74C | 75D |
| 76D | 77C | 78D | 79D | 80B |
Câu 45:
Kim loại Al tác dụng với dung dịch NaOH sinh ra khí H2:
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
Câu 46:
A. Không phản ứng.
B. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
C. NaOH + HCl → NaCl + H2O
D. Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Câu 47:
Gly–Ala là H2N-CH2-CONH-CH(CH3)-COOH có 5 nguyên tử C trong phân tử.
Câu 49:
Fe + S (t°) → FeS
Trong sản phẩm FeS, sắt có số oxi hóa +2.
Câu 52:
Để bảo vệ ống thép dẫn dầu bằng phương pháp điện hoá cần gắn vào mặt ngoài của ống những khối kim loại Zn vì khi hình thành cặp điện cực Zn-Fe thì Zn có tính khử mạnh hơn Fe nên Zn là cực âm, bị ăn mòn và Fe là cực dương, được bảo vệ.
Sau một thời gian khối Zn bị ăn mòn hết sẽ phải thay thế bằng khối Zn khác.
Câu 55:
Nhỏ từ từ đến dư dung dịch NH3 vào ống nghiệm đựng dung dịch AlCl3 thu được kết tủa keo, màu trắng:
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
NH3 có tính bazơ yếu, không hòa tan được Al(OH)3. Mặt khác Al(OH)3 cũng không có khả năng tạo phức với NH3 nên kết tủa này còn nguyên khi NH3 dư.
Câu 57:
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các ion gây ra tính cứng tới mức chấp nhận được, đó là các ion Ca2+, Mg2+.
Câu 59:
Amin bậc 1 do 1H trong NH3 bị thay thế bởi 1 gốc hiđrocacbon → CH3NH2 (Metylamin) là amin bậc 1.
Câu 61:
A. Sai, Fe bị thụ động nên không tan trong H2SO4 đặc, nguội.
B. Đúng: Fe + 2HCl → FeCl2 + H2
C. Sai: Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
D. Sai, ion Fe2+ có thể thể hiện tính khử, tính oxi hóa hoặc không thay đổi số oxi hóa trong các phản ứng hóa học.
Câu 62:
C6H12O6 → 2C2H5OH + 2CO2
mC2H5OH = 70%.180.2.46/180 = 64,4 gam
Câu 63:
(C17H33COO)3C3H5 + 3H2 → (C17H35COO)3C3H5
n(C17H33COO)3C3H5 = 17,68/884 = 0,02
→ nH2 = b = 0,06
Câu 64:
A. Sai, dung dịch saccarozơ không có phản ứng tráng bạc.
B. Sai, tinh bột và xenlulozơ có công thức phân tử khác nhau (số mắt xích khác nhau) nên không phải là đồng phân của nhau.
C. Sai, saccarozơ thuộc loại đisaccarit.
D. Đúng, glucozơ có các chức anđehit và ancol nên là hợp chất hữu cơ tạp chức.
Câu 65:
Có 2 dung dịch tác dụng với lượng dư dung dịch Ba(OH)2 thu được kết tủa là Na2CO3, FeSO4:
Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
FeSO4 + Ba(OH)2 → Fe(OH)2↓ + BaSO4↓
Còn lại KCl không phản ứng với dung dịch Ba(OH)2; HCl có phản ứng với dung dịch Ba(OH)2 nhưng không tạo kết tủa:
2HCl + Ba(OH)2 → BaCl2 + 2H2O
Câu 66:
MCO3 + 2HCl → MCl2 + CO2 + H2O
Trong phản ứng trên, 1 gốc CO32- (60) được thay thế bởi 2 gốc Cl– (71) nên:
nMCO3 = (19 – 16,8)/(71 – 60) = 0,2
→ M + 60 = 16,8/0,2 → M = 24: M là Mg
Câu 67:
Amin X có tỉ lệ C : H = 0,6 : (1,05.2) = 2 : 7
→ X dạng C2xH7xN
→ 7x ≤ 2.2x + 3 → x ≤ 1 → x = 1 là nghiệm duy nhất.
X là C2H7N.
Câu 68:
A. Sai, trùng hợp buta-1,3-đien thu được polime dùng để sản xuất cao su buna.
B. Đúng
C. Sai, đồng trùng hợp buta-1,3-đien và stiren thu được polime dùng để sản xuất cao su buna–S.
D. Sai, lưu huỳnh không tham gia phản ứng trùng hợp cùng buta-1,3-đien.
Câu 69:
Cu + 2H2SO4 đặc nóng → CuSO4 + SO2 + 2H2O
→ nSO2 = y = nCu = 0,1
Câu 70:
Ancol Y tham gia phản ứng lên men giấm tạo CH3COOH nên Y là C2H5OH
→ X là CH3COOC2H5.
Câu 71:
Các cặp chất X, Y, Z, T:
H2N-CH2-COONH3-CH3; CH3NH2; H2N-CH2-COONa; H2N-CH2-COOH
H2N-CH2-CH2-COONH4; NH3; H2N-CH2-CH2-COONa; H2N-CH2-CH2-COOH
H2N-CH(CH3)-COONH4; NH3; H2N-CH(CH3)-COONa; H2N-CH(CH3)-COOH
(a) Đúng, T có 1NH2 và 1COOH nên không làm đổi màu quỳ tím.
(b) Sai, nX : nNaOH = 1 : 1
(c) Sai, Y tan tốt trong nước tạo dung dịch có pH > 7
(d) Đúng
(đ) Sai, Y có 1 nguyên tử nitơ trong phân tử.
Câu 72:
nFe = 6,72.7,9/(79%.56) = 1,2 mol
2Al + Fe2O3 → Al2O3 + 2Fe
→ nAl phản ứng = 1,2 và nFe2O3 phản ứng = 0,6
→ m cần dùng = (1,2.27 + 0,6.160)/96% = 133,75 gam
Câu 73:
(a) Đúng, do cả 2 ống nghiệm đều xảy ra chung phản ứng:
Zn + H2SO4 → ZnSO4 + H2
(b) Sai, Zn bị oxi hóa thành Zn2+ (Zn → Zn2+ + 2e)
(c) Đúng:
+ Ống 1 có H2 thoát ra chậm do bọt khí H2 bao kín thanh Zn, ngăn cản Zn tiếp xúc với H2SO4 làm giảm tốc độ phản ứng.
+ Ống 2 có H2 thoát ra nhanh hơn do:
Zn + Cu2+ → Zn2+ + Cu
Vụn Cu sinh ra bám vào Zn tạo cặp điện cực Zn-Cu, trong đó Cu là cực dương và H2 thoát ra tại đây nên không ngăn cản Zn tiếp xúc với H2SO4.
(d) Đúng
(đ) Sai, Zn bị ăn mòn điện hóa trong ống 2 (do có cặp điện cực Zn-Cu), ở ống 1 Zn chỉ bị ăn mòn hóa học.
Câu 74:
nCO2 = 0,05; nSO2 = 0,1 (bấm hệ n khí và m khí)
Quy đổi X thành kim loại, CO2 (0,05) và O
nH2SO4 ban đầu = nH2SO4 phản ứng + 20%nH2SO4 phản ứng
nH2SO4 phản ứng = 0,72/1,2 = 2nSO2 + nO
→ nO = 0,4
Z gồm CO2 (0,05) và H2 (0,07 – 0,05 = 0,02 mol)
nH2O = nO = 0,4
Bảo toàn H: nHCl = 2nH2O + 2nH2 = 0,84
Bảo toàn Cl → nAgCl = 0,84
Bảo toàn electron: 2nSO2 = ne của X nhường = 2nH2 + nAg
→ nAg = 0,16
→ m↓ = mAgCl + mAg = 137,82 gam
Câu 75:
T chứa nC = 20,56.23,346%/12 = 0,4; nH = 20,56.1,751%/1 = 0,36; nNa = t và nO = 2t
mT = 0,4.12 + 0,36.1 + 23t + 16.2t = 20,56
→ t = 0,28
Quy đổi T thành COONa (0,28), C (0,12) và H (0,36)
nH = 3nC và muối không tráng bạc → T gồm CH3COONa (0,12) và (COONa)2 (0,08)
nC(E) = 18,14.44,984%/12 = 0,68
Bảo toàn C → nC(ancol) = 0,28
nO(ancol) = nNaOH = 0,28 → Ancol có số C = Số O
Bảo toàn khối lượng → mAncol = 8,78
nH(ancol) = (mAncol – mC – mO)/1 = 0,94
→ nAncol = nH/2 – nC = 0,19
Số C của ancol = 0,28/0,19 = 1,47 → Có CH3OH
MX < MY < MZ < 234 nên este không quá 3 chức
TH1: Ancol gồm CH3OH (0,1) và C2H4(OH)2 (0,09) (Bấm hệ nAncol và nC)
X là (COOCH3)2: 0,02
Y là (CH3COO)2C2H4: 0,03
Z là CH3COO-CH2-CH2-OOC-COO-CH3: 0,06
(Bấm hệ nAncol và nMuối để tính)
→ mY = 4,38 gam
TH2: Ancol gồm CH3OH (0,145) và C3H5(OH)3 (0,045)
Không ghép với 2 muối để tạo 3 este đa chức có MX < MY < MZ < 234 được nên loại.
Câu 76:
(a) Sai, công thức phân tử của anilin là C6H7N; của alanin là C3H7O2N.
(b) Đúng, glucozơ có công thức phân tử là C6H12O6.
(c) Sai, tất cả các este đều ít tan.
(d) Đúng, glucozơ có phản ứng tráng gương (tạo kết tủa Ag trắng sáng), glixerol không có phản ứng này.
(đ) Đúng
Câu 77:
pH = 13 → [OH-] = 0,1 → nOH– = 0,048
H3PO4 + OH– → H2PO4– + H2O (1)
H3PO4 + 2OH– → HPO42- + 2H2O (2)
H3PO4 + 3OH– → PO43- + 3H2O (3)
Δm1 = 0,048.97 – 0,048.17 = 3,84
Δm2 = 0,024.96 – 0,048.17 = 1,488
Δm3 = 0,016.95 – 0,048.17 = 0,704
Theo đề Δm = 1,194 nằm trong khoảng Δm2 và Δm3 nên đã xảy ra các phản ứng (2)(3)
nHPO42- = x và nPO43- = y → 2x + 3y = 0,048
Δm = 96x + 95y – 0,048.17 = 1,194
→ x = 0,015; y = 0,006
Bảo toàn P → nP = x + y = 0,021 → mP = 0,651
Câu 78:
CuSO4 + H2O → Cu (catot) + ½O2 (anot) + H2SO4
Catot xuất hiện bọt khí khi Cu2+ vừa hết, dung dịch X chỉ chứa chất tan H2SO4
X + Mg, Fe tạo ra hỗn hợp chất rắn T (gồm Fe và Mg dư) nên Y chứa MgSO4, khí Z là H2.
(a) Đúng, Cu bám vào catot làm khối lượng điện cực catot tăng.
(b) Sai, nCu = 2nO2
(c) Đúng:
Mg + Fe2(SO4)3 dư → MgSO4 + 2FeSO4
Fe + Fe2(SO4)3 dư → 3FeSO4
(d) Đúng:
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
(đ) Sai, H2 không khử được K2O.
Câu 79:
mNa2CO3 ban đầu = 100.21,5/(100 + 21,5) = 17,6955 gam
mNa2CO3 còn lại trong dung dịch sau khi làm lạnh = (100 – m).12,5/(100 + 12,5) = 17,6955 – 106m/286
→ m = 25,37 gam
Câu 80:
mHOC6H4COOCH3 = 3,8.106.2,7 = 1,026.107 gam = 10,26 tấn
→ mHOC6H4COOH = 10,26.138/(152.75%) = 12,42 tấn






