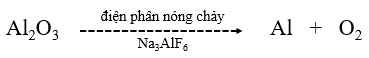- Chuyên Đề KHTN 8 Cánh Diều Bài Mở Đầu
- Chuyên Đề KHTN 8 Cánh Diều Bài 1 Biến Đổi Vật Lí Và Biến Đổi Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 2 Phản Ứng Hóa Học Và Năng Lượng Của Phản Ứng Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 3 Định Luật Bảo Toàn Khối Lượng Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 4 Mol Và Tỉ Khối Của Chất Khí
- Chuyên Đề KHTN 8 Cánh Diều Bài 5 Tính Theo Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 6 Nồng Độ Dung Dịch
- Chuyên Đề KHTN 8 Cánh Diều Bài 7 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Cánh Diều Bài 8 Acid
- Chuyên Đề KHTN 8 Cánh Diều Bài 9 Base
- Chuyên Đề KHTN 8 Cánh Diều Bài 10 Thang pH
- Chuyên Đề KHTN 8 Cánh Diều Bài 11 Oxide
- Chuyên Đề KHTN 8 Cánh Diều Bài 12 Muối
- Chuyên Đề KHTN 8 Cánh Diều Bài 13 Phân Bón Hóa Học
Chuyên đề KHTN 8 Cánh diều bài 5 Tính theo phương trình hóa học được soạn dưới dạng file word và PDF gồm 8 trang. Các bạn xem và tải về ở dưới.
BÀI 5: TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC
(Sách KHTN 8 – Cánh diều)
A. TÓM TẮT LÝ THUYẾT
1. Các bước tính khối lượng và số mol của chất tham gia, chất sản phẩm trong phản ứng hóa học:
Bước 1: Viết phương trình hóa học của phản ứng.
Bước 2: Tính số mol chất đã biết dựa vào khối lượng hoặc thể tích:
$n = \frac{m}{M}$; $n = \frac{V}{{24,79}}$
Trong đó:
n: số mol (mol).
m: khối lượng các chất (gam).
M: khối lượng mol (gam/mol).
24,79 (L/mol) thể tích ở điều kiện tiêu chuẩn áp suất 1bar ở 250C.
Bước 3: Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất sản phẩm.
Bước 4: Tính khối lượng hoặc thể tích của chất cần tìm:
m = n.M; V = n.24,79
2. Hiệu suất phản ứng: là tỉ số giữa lượng chất sản phẩm thu được theo thực tế và lượng sản phẩm thu được theo lí thuyết.
$H = \frac{{{m_{sp\,thực\,tế}}}}{{{m_{sp\,\,lí\,\,thuyết}}}}.100 = \frac{{{n_{sp\,thực\,tế}}}}{{{n_{sp\,\,lí\,\,thuyết}}}}.100 = \frac{{{V_{sp\,thực\,tế}}}}{{{V_{sp\,\,lí\,\,thuyết}}}}.100\,(\% )$
Trong đó:
H: hiệu suất phản ứng (%)
msp thực tế: khối lượng sản phẩm thu được thực tế.
msp lí thuyết: khối lượng sản phẩm tính theo lí thuyết.
Vsp thực tế: thể tích thu được thực tế.
Vsp lí thuyết: thể tích tính được theo lí thuyết.
B. CÂU HỎI TRONG BÀI HỌC
Câu 1. [CD – SGK trang 33]
Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide theo sơ đồ phản ứng:
$Al{\text{ }} + {\text{ }}{O_2}\; \to A{l_2}{O_3}$
Lập phương trình hóa học của phản ứng rồi tính:
a. Khối lượng aluminium oxide tạo ra.
b. Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn
Bài giải
a. ${n_{Al}} = \frac{m}{M} = \frac{{0,54}}{{27}} = 0,02{\text{ (}}mol)$
| $4Al\;\;\;\; + \;\;\;\;3{O_2} \to \;2A{l_2}{O_3}$ | ||
| Tỉ lệ phản ứng: | 4 3 2 | (mol) |
| Phản ứng | 0,02 → 0,015 0,01 | (mol) |
Vậy 0,02 mol Al phản ứng với 0,15 mol O2 và tạo ra 0,01 mol Al2O3
Khối lượng aluminium oxide tạo ra là:
${m_{A{l_2}{O_3}}} = {n_{A{l_2}{O_3}}}.{M_{A{l_2}{O_3}}} = 0,01.102 = 1,02{\text{ (gam}})$
b. Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn là:
${V_{{O_2}}} = {n_{{O_2}}}.24,79 = 0,015.24,79 = 0,37185{\text{ (l}})$
Câu 2. [CD – SGK trang 33]
Đốt cháy hết 1 mol khí hydrogen trong 0,4 mol khí oxygen đến khi phản ứng xảy ra hoàn toàn. Cho biết chất nào còn dư sau phản ứng.
Bài giải
| ${\mathbf{2}}{H_2}\; + \;{O_{2\;}} \to \;{\mathbf{2}}{H_2}O$ | ||
| Tỉ lệ phản ứng: | 2 1 2 | (mol) |
| Ban đầu: | 1 0,4 | (mol) |
| Tỉ lệ: | $\frac{1}{2}$ > $\frac{{0,4}}{1}$ | |
| Kết luận: | dư hết |
Vậy hydrogen còn dư sau phản ứng
Câu 3. [CD – SGK trang 35]
Trong công nghiệp, nhôm được sản xuất từ aluminium oxide (Al2O3) theo phương trình hóa học sau:
$2A{l_2}O3\;\;\;\; \to \;\;\;\;4Al\;\;\;\; + \;\;\;\;3{O_2}$
a. Tính hiệu suất phản ứng khi điện phân 102 kg Al2O3, biết khối lượng nhôm thu được sau phản ứng là 51,3 kg.
b*. Biết khối lượng nhôm thu được sau điện phân là 54 kg và hiệu suất phản ứng là 92%, tính khối lượng Al2O3 đã dùng
Bài giải
a. Đổi đơn vị: 102 kg = 102 000 g
${n_{A{l_2}{O_3}}} = \frac{n}{M} = \frac{{102000}}{{102}} = 1000{\text{ (}}mol)$
| $2A{l_2}O3\; \to\;4Al\; + \;3{O_2}$ | ||
| Tỉ lệ phản ứng: | 2 4 3 | (mol) |
| Phản ứng: | 1000 → 2000 | (mol) |
Khối lượng nhôm thu được theo lí thuyết là:
${m_{Al(lt)}} = {n_{Al}}.{M_{Al}} = 2000.27 = 54000{\text{ (gam}}) = 54(kg)$
Hiệu suất của phản ứng là:
b. Đổi đơn vị: 54 kg = 54000 g
${n_{Al}} = \frac{m}{M} = \frac{{54000}}{{27}} = 2000{\text{ (}}mol)$
| $2A{l_2}O3\; \to \;4Al\; + \;3{O_2}$ | ||
| Tỉ lệ phản ứng: | 2 4 3 | (mol) |
| Phản ứng: | 1000 ← 2000 | (mol) |
Khối lượng aluminium oxide đã tham gia phản ứng là:
${m_{A{l_2}{O_3}(tt)}} = n.M = 1000.102 = 102000{\text{ (gam}}) = 102(kg)$
Vì hiệu suất phản ứng là 92% ⇒ Khối lượng aluminium oxide cần dùng là:
${m_{A{l_2}{O_3}}} = 102.\frac{{100}}{{92}} \approx 110,9(kg)$
C. CÂU HỎI CUỐI BÀI HỌC (không có)
D. TỰ LUẬN
Câu 1: Nung nóng để phân huỷ hoàn toàn 25 gam CaCO3 (thành phần chính của đá vôi), thu được vôi sống (CaO) và khí carbon dioxide (CO2).
a. Hãy tính khối lượng vôi sống thu được sau khi nung, biết hiệu suất của phản ứng là 100%.
b. Hãy tính thể tích khí carbon dioxide thải ra ngoài môi trường (ở đkc), biết hiệu suất của phản ứng là 85%.
Bài giải
${n_{CaC{O_3}}} = \frac{{{m_{CaC{O_3}}}}}{{{M_{CaC{O_3}}}}} = \frac{{25}}{{100}} = 0,25\,(mol)$
| $CaC{O_3}\xrightarrow{{{t^0}}}CaO + C{O_2}$ | ||
| Tỉ lệ phản ứng: | 1 1 1 | (mol) |
| Phản ứng: | 0,25 → 0,25 0,25 | (mol) |
a. Khối lượng vôi sống thu được sau khi nung là:
mCaO = nCaO . MCaO = 0,25 . 56 = 14 (g)
b. Thể tích khí carbon dioxide thải ra ngoài môi trường (ở đkc) là:
${V_{C{O_2}}} = n.24,79 = 0,25.24,79 = 6,1975{\text{ }}(l)$
Mà H = 85% ⇒ Thể tích khí carbon dioxide thải ra ngoài môi trường (ở đkc) là:
${V_{C{O_2}}} = 6,1975.\frac{{85}}{{100}}{\text{ = 5,267875 }}(l)$
Câu 2: Lập phương trình hóa học của phản ứng giữa hydrochloric acid tác dụng với Zn theo sơ đồ sau:
$Zn + HCl – – \to ZnC{l_2} + {H_2}$
Biết rằng sau phản ứng thu được 7,437 lít khí hydrogen (đkc), hãy tính:
a. Khối lượng Zn đã phản ứng.
b. Khối lượng hydrochloric acid đã phản ứng.
c. Khối lượng zinc chloride ZnCl2 tạo thành theo 2 cách
Bài giải
a. ${n_{{H_2}}} = \frac{V}{{24,79}} = \frac{{7,437}}{{24,79}} = 0,3{\text{ }}(mol)$
| $Zn + 2HCl \to ZnC{l_2} + {H_2}$ | ||
| Tỉ lệ phản ứng: | 1 2 1 1 | (mol) |
| Phản ứng: | 0,3 0,6 0,3 ← 0,3 | (mol) |
Khối lượng Zn đã phản ứng là:
mZn = n.M = 0,3.65 = 19,5 (g)
b. Khối lượng hydrochloric acid đã phản ứng là:
mHCl = n.M = 0,6.36,5 = 21,9 (g)
c. Cách 1: Khối lượng zinc chloride ZnCl2 tạo thành là:
mZnCl2 = n.M = 0,3.136 = 40,8 (g)
Cách 2: Theo định luật bảo toàn khối lượng, khối lượng zinc chloride ZnCl2 tạo thành là:
mZnCl2 = mZn + mHCl – mH2 = 19,5 + 21,9 – 0,3.2 = 40,8 (g)
Câu 3: Nhiệt phân copper(II) nitrate Cu(NO3)2 thu được copper(II) oxide CuO, nitrogen dioxide NO2 và khí oxygen O2.
a. Lập phương trình hóa học của phản ứng.
b. Nếu nhiệt phân hoàn toàn 28,2 gam copper(II) nitrate với hiệu suất phản ứng 100% thì thu được bao nhiêu gam copper(II) oxide và bao nhiêu lít khí oxygen ở đkc?
c. Muốn thu được 6,1975 lít (đkc) hỗn hợp 2 khí NO2 và O2 thì phải nhiệt phân bao nhiêu gam copper(II) nitrate, biết hiệu suất phản ứng đạt 80%.
Bài giải
| a. | $2Cu{\left( {N{O_3}} \right)_2}\xrightarrow{{{t^0}}}2CuO + 4N{O_2} + {O_2}$ |
b. ${n_{Cu{{(N{O_3})}_2}}} = \frac{m}{M} = \frac{{28,2}}{{188}} = 0,15{\text{ }}(mol)$
| $2Cu{\left( {N{O_3}} \right)_2}\xrightarrow{{{t^0}}}2CuO + 4N{O_2}+ {O_2}$ | ||
| Tỉ lệ phản ứng: | 2 2 4 1 | (mol) |
| Phản ứng: | 0,15 → 0,15 0,3 0,075 | (mol) |
Khối lượng copper(II) oxide thu được là:
mCuO = n.M = 0,15.80 = 12,0 (g)
Thể tích khí oxygen (ở đkc) thu được là:
${V_{{O_2}}} = n.24,79 = 0,075.24,79 = 1,85925{\text{ }}(l)$
c. ${n_{N{O_2},{O_2}}} = \frac{V}{{24,79}} = \frac{{6,1975}}{{24,79}} = 0,25{\text{ }}(mol)$
Gọi số mol Cu(NO3)2 = x (mol)
| $2Cu{\left( {N{O_3}} \right)_2}\xrightarrow{{{t^0}}}2CuO + 4N{O_2} +{O_2}$ | ||
| Tỉ lệ phản ứng: | 2 2 4 1 | (mol) |
| Phản ứng: | x → x 2x 0,5x | (mol) |
${n_{N{O_2},{O_2}}} = 2x + 0,5x = 0,25{\text{ }} \Rightarrow {\text{ x = 0,1 (mol)}}$
Khối lượng copper(II) nitrate đã phản ứng là:
${m_{Cu{{(N{O_3})}_2}}} = n.M = 0,1.188 = 18,8{\text{ }}(gam)$
Mà H = 80% ⇒ Khối lượng copper(II) nitrate đem nhiệt phân là:
${m_{Cu{{(N{O_3})}_2}}} = 18,8.\frac{{100}}{{80}}{\text{ = 23,5 }}(gam)$
Câu 4: Trong công nghiệp, quá trình điện phân dung dịch NaCl bão hòa (cực âm bằng sắt và cực dương bằng than chì, có màng ngăn điện cực) là cơ sở của công nghiệp sản xuất xút-chlorine.
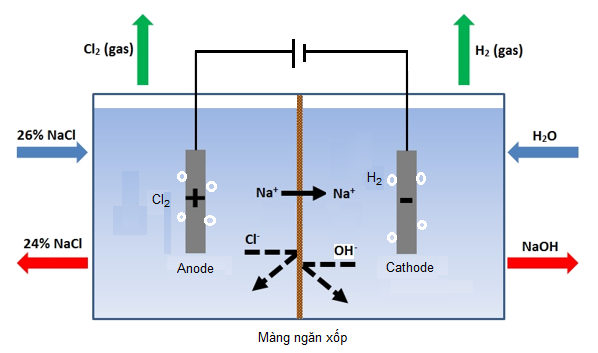
Biết trong quá trình điện phân dung dịch NaCl bão hòa xảy ra phản ứng theo sơ đồ sau:

a. Lập phương trình hóa học của phản ứng.
b. Trong thực tiễn, khí chlorine thu được từ phản ứng đã cho đang được sử dụng làm chất diệt trùng nước sinh hoạt ở nước ta. Hãy tính khối lượng NaCl (tấn) cần dùng trong 1 ngày để tạo ra lượng chlorine diệt trùng nước sinh hoạt cung cấp cho thành phố lớn có dân số 7,1 triệu người.
Giả thiết:
─ Tiêu chuẩn nước sinh hoạt trung bình của 1 người dân thành phố trên là 200 lít nước/ngày.
─ Hàm lượng chlorine cần dùng để diệt trùng là 5 gam/1 m3 nước sinh hoạt.
─ Hiệu suất phản ứng điện phân dung dịch NaCl bão hòa là 100%
Bài giải
a. 2NaCl + 2H2O 2NaOH + H2 + Cl2
b. Trong 1 ngày, tổng thể tích nước mà 7,1 triệu dân sử dụng là:
${V_{{H_2}O}} = 200.7100000 = 14,{2.10^8}{\text{ (l) = 14,2}}{\text{.1}}{{\text{0}}^{\text{5}}}{\text{ (}}{{\text{m}}^{\text{3}}}{\text{)}}$
Khối lượng chlorine cần dùng để diệt trùng lượng nước trên là:
${m_{C{l_2}}} = 5.{\text{14,2}}{\text{.1}}{{\text{0}}^{\text{5}}}{\text{ = 71}}{\text{.1}}{{\text{0}}^{\text{5}}}{\text{ (gam)}}$
Số mol chlorine là:
${n_{C{l_2}}} = \frac{m}{M} = \frac{{7,{{1.10}^5}}}{{71}} = 10000{\text{ }}(mol)$
| 2NaCl + 2H2O$\xrightarrow[{màn\,ngăn}]{{điện\,phân\,dung\,dịch}}$2NaOH + H2 + Cl2 | ||
| Tỉ lệ phản ứng: | 2 2 2 1 1 | (mol) |
| Phản ứng: | 20000 ← 10000 | (mol) |
Khối lượng NaCl cần dùng là:
${m_{NaCl}} = n.M = 2000.58,5 = 1170000{\text{ }}(gam) = 1,17$ (tấn)
| Câu 5. Ở một nhà máy, nhôm được sản xuất bằng phương pháp điện phân nóng chảy aluminium oxide Al2O3 theo sơ đồ phản ứng sau:
Biết mỗi ngày công ty sản xuất 27 tấn Al. Tính khối lượng aluminium oxide đã dùng trong 1 ngày, giả sử hiệu suất phản ứng là 85% |
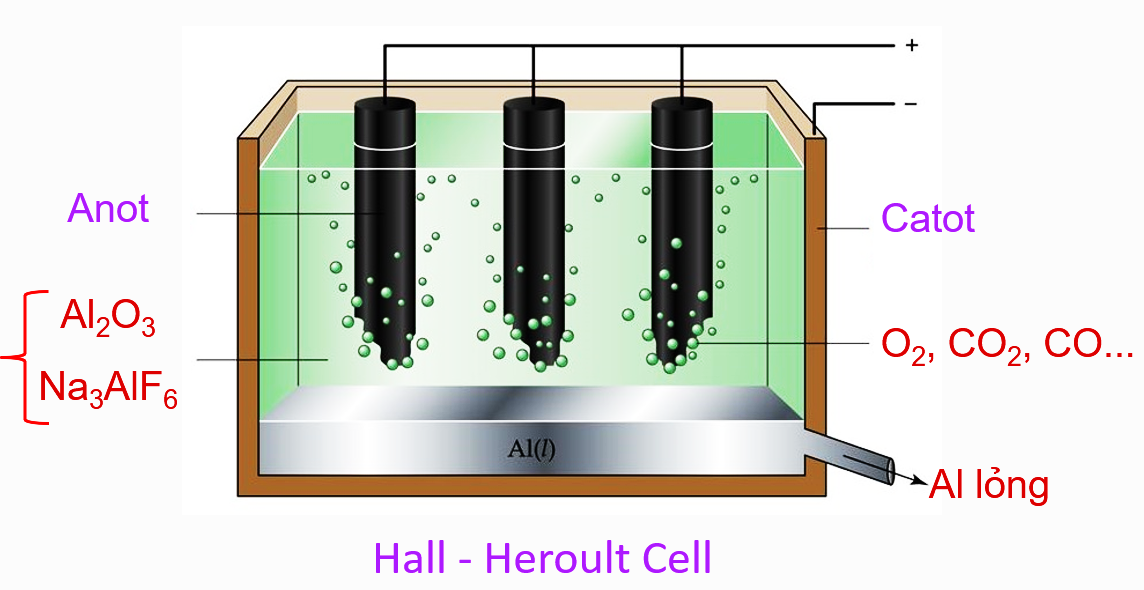 |
Bài giải
Đổi: 27 tấn = 27 000 000 gam
${n_{Al}} = \frac{m}{M} = \frac{{{\text{27 000 000}}}}{{27}} = {\text{1 000 000 }}(mol)$
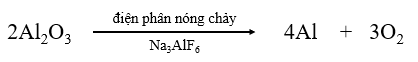 |
||
| Tỉ lệ phản ứng: | 2 4 3 | (mol) |
| Phản ứng: | 500 000 ← 1 000 000 | (mol) |
Khối lượng aluminium oxide đã dùng trong 1 ngày là:
mAl2O3 = n.M = 500 000.102 = 51 000 000 (g) = 51 tấn
Mà H = 85% ⇒ Khối lượng aluminium oxide đã dùng trong 1 ngày là:
${m_{A{l_2}{O_3}}} = 51.\frac{{100}}{{85}}{\text{ = 60 }}$ (tấn)
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1: Cho phương trình hóa học nhiệt phân muối calcium carbonate: $CaC{{\text{O}}_3}\xrightarrow{{{t^o}}}CaO + C{O_2}.$ Số mol CaCO3 cần dùng để điều chế được 0,2 mol CaO là
A. 0,2 mol. B. 0,3 mol. C. 0,4 mol. D. 0,1 mol.
Câu 2: Cho phương trình hóa học sau: $2Fe + \,\,\,3C{l_2}\xrightarrow{{{t^0}}}\,\,2FeC{l_3}.$ Khối lượng Fe cần dùng để điều chế được 2 mol iron(III) chloride là
A. 3 mol. B. 2 mol. C. 1 mol. D. 1,5 mol.
Câu 3: Cho phương trình hóa học sau: $2KMn{O_4}\xrightarrow{{{t^o}}}{K_2}Mn{O_4} + Mn{O_2} + {O_2} \uparrow .$ Thể tích khí O2 (đkc) thu được khi nhiệt phân hoàn toàn 1 mol KMnO4 là
A. 24,79 lít. B. 49,58 lít. C. 12,395 lít. D. 11,2 lít.
Câu 4: Cho sơ đồ phản ứng sau:
![]()
Sau phản ứng thu được 7,437 lít (đkc) khí hidrogen thì số mol của Al đã tham gia phản ứng là
A. 0,3 mol. B. 0,2 mol. C. 0,1 mol. D. 0,15 mol.
Câu 5: Một nhà máy dự tính sản xuất 100 tấn NH3 từ N2 và H2 trong điều kiện thích hợp. Tuy nhiên, khi đưa vào quy trình sản xuất thực tế chỉ thu được 25 tấn NH3. Hiệu suất của phản ứng sản xuất NH3 nói trên là
A. 4,0% gam. B. 25,0%. C. 40%. D. 2,5 %.
Câu 6: Một nhà máy dự tính sản xuất 80 tấn vôi sống CaO từ đá vôi. Tuy nhiên, khi đưa vào quy trình sản xuất thực tế chỉ thu được 25 tấn CaO. Hiệu suất của quá trình nói trên là
A. 25,0% gam. B. 30,5 %. C. 32,0%. D. 31,25%.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 |
| A | B | C | B | B |
D |
MỨC ĐỘ 2: HIỂU (5 câu )
Câu 8: Cho sơ đồ phản ứng sau:
![]()
Sau phản ứng thu được 7,437 lít (đkc) khí hidrogen thì khối lượng của Zn đã tham gia phản ứng là
A. 13,0 gam. B. 19,5 gam. C. 15,9 gam. D. 26,0 gam.
Câu 9: Cho kim loại sắt tác dụng với dung dịch H2SO4 loãng, thu được FeSO4 và khí hidrogen. Nếu dùng 5,6 gam sắt thì số mol H2SO4 cần để phản ứng là bao nhiêu?
A. 1 mol. B. 0,3 mol. C. 0,2 mol. D. 0,1 mol.
Câu 10: Cho 3 phân tử H2 tác dụng với 1 phân tử O2 (trong điều kiện thích hợp):
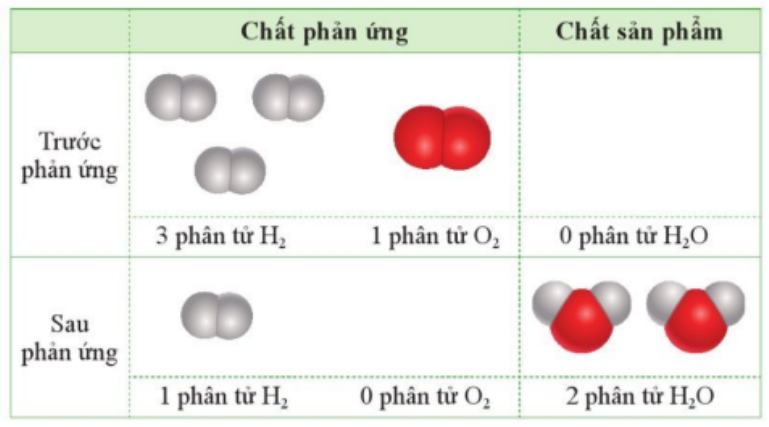
Chọn phát biểu đúng trong những phát biểu dưới đây:
A. Sau khi phản ứng xảy ra hoàn toàn, chỉ thu được 2 phân tử nước, không còn phân tử H2 và O2.
B. Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử H2 dư.
C. Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử O2 dư.
C. Sau khi phản ứng xảy ra hoàn toàn, thu được 1 phân tử nước và còn 1 phân tử H2 dư.
Câu 11: Nếu đốt 12,0 gam carbon trong khí oxygen dư thu được 39,6 gam CO2 thì hiệu suất phản ứng là
A. 90,0%. B. 80%. C. 95%. D. 85%..
Câu 12: Đốt 32,0 gam Sulfur trong khí oxygen dư, tính khối lượng SO2 thu được nếu hiệu suất phản ứng đạt 80%.
A. 64 gam. B. 52,1 gam. C. 80 gam. D. 51,2 gam.
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| B | D | B | A |
D |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT): 3 câu
Câu 13: Đốt cháy hoàn toàn 7,5 gam than đá (biết than đá có thành phần chính là carbon, chứa 4% tạp chất không cháy) thu được CO2. Thể tích khí oxi cần dùng (đkc) để đốt cháy hết lượng than đá trên là
A. 15,29 lít. C. 33,6 lít. B. 67,2 lít. D. 14,874 lít.
Bài giải
Khối lượng carbon nguyên chất trong 7,5 gam than đá là: mC = 7,5 . $\frac{{100 – 4}}{{100}} = 7,2{\text{ }}(gam)$
$ \Rightarrow {n_C} = \frac{m}{M} = \frac{{7,2}}{{12}} = 0,6{\text{ }}(mol)$
| C + O2 $\xrightarrow{{{t^0}}}$ CO2 | ||
| Tỉ lệ phản ứng: | 1 1 | (mol) |
| Phản ứng: | 0,6→0,6 | (mol) |
$ \Rightarrow {V_{{O_2}}} = {n_{{O_2}}}.24,79 = 14,874{\text{ }}(lit)$
Chọn D
Câu 14: Cho hỗn hợp X (chứa 2,3 gam natri và 1,95 gam kali) tác dụng hết với nước, thu được khí hidrogen và dung dịch chứa NaOH và KOH. Thể tích khí hiđro thu được (đkc) là
A. 3,7185 lít. B. 1,85925 lít. C. 1,7353 lít. D. 2,6848 lít.
Bài giải
${n_{Na}} = \frac{m}{M} = \frac{{2,3}}{{23}} = 0,1{\text{ }}(mol)$ ${n_K} = \frac{m}{M} = \frac{{1,95}}{{39}} = 0,05{\text{ }}(mol)$
| 2Na + 2H2O $\xrightarrow{{{t^0}}}$ 2NaOH + H2 | ||
| Tỉ lệ phản ứng: | 2 1 | (mol) |
| Phản ứng: | 0,1 → 0,05 | (mol) |
| 2K + 2H2O $\xrightarrow{{{t^0}}}$ 2KOH + H2 | ||
| Tỉ lệ phản ứng: | 2 1 | (mol) |
| Phản ứng: | 0,05 → 0,025 | (mol) |
$ \Rightarrow {n_{{H_2}}} = 0,05 + 0,025 = 0,075{\text{ }}(mol)$ $ \Rightarrow {V_{{H_2}}} = {n_{{O_2}}}.24,79 = 0,075.24,79 = 1,85925(lit)$
Chọn B
Câu 15: Trộn 4 gam bột sulfur với 14 gam bột sắt rồi nung nóng trong điều kiện không có không khí. Khối lượng FeS thu được sau phản ứng là
A. 18 gam. B. 16 gam. C. 11,0 gam. D. 13 gam.
Bài giải
${n_S} = \frac{m}{M} = \frac{4}{{32}} = 0,125{\text{ }}(mol)$ ${n_{Fe}} = \frac{m}{M} = \frac{{14}}{{56}} = 0,25{\text{ }}(mol)$
| Fe + S $\xrightarrow{{{t^0}}}$ FeS | ||
| Tỉ lệ phản ứng: | 1 1 1 | (mol) |
| Đề bài: | 0,25 0,125 | (mol) |
| Tỉ lệ: | $\frac{{0,25}}{1}$ > $\frac{{0,125}}{1}$ | |
| Fe dư S hết | ||
| Phản ứng: | 0,125 → 0,125 | (mol) |
mFeS = n.M = 0,125.88 = 11,0 (g)
Chọn C