- Chuyên Đề KHTN 8 Cánh Diều Bài Mở Đầu
- Chuyên Đề KHTN 8 Cánh Diều Bài 1 Biến Đổi Vật Lí Và Biến Đổi Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 2 Phản Ứng Hóa Học Và Năng Lượng Của Phản Ứng Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 3 Định Luật Bảo Toàn Khối Lượng Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 4 Mol Và Tỉ Khối Của Chất Khí
- Chuyên Đề KHTN 8 Cánh Diều Bài 5 Tính Theo Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 6 Nồng Độ Dung Dịch
- Chuyên Đề KHTN 8 Cánh Diều Bài 7 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Cánh Diều Bài 8 Acid
- Chuyên Đề KHTN 8 Cánh Diều Bài 9 Base
- Chuyên Đề KHTN 8 Cánh Diều Bài 10 Thang pH
- Chuyên Đề KHTN 8 Cánh Diều Bài 11 Oxide
- Chuyên Đề KHTN 8 Cánh Diều Bài 12 Muối
- Chuyên Đề KHTN 8 Cánh Diều Bài 13 Phân Bón Hóa Học
Chuyên đề KHTN 8 Cánh diều bài 3 Định luật bảo toàn khối lượng phương trình hóa học được soạn dưới dạng file word và PDF gồm 9 trang. Các bạn xem và tải về ở dưới.
BÀI 3: ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG-PHƯƠNG TRÌNH HÓA HỌC
A. TÓM TẮT LÝ THUYẾT
I. Định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
Giải thích: Trong phản ứng hoá học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử; số nguyên tử của mỗi nguyên tố trước và sau phản ứng không thay đổi, khối lượng nguyên tử không thay đổi. Vì vậy, tổng khối lượng của các chất được bảo toàn.
II. Áp dụng định luật bảo toàn khối lượng
Cho phương trình hóa học: $A + B \to C + D$
-Phương trình theo bảo toàn khối lượng: ${m_A} + {m_B} = {m_C} + {m_D}$
Với: mA, mB, mC, mD là khối lượng chất tham gia phản ứng và sản phẩm phản ứng.
– Áp dụng định luật bảo toàn khối lượng để tính khối lượng các chất trong phản ứng hoá học.
Ví dụ: Tính khối lượng NaCl (Sodium chloride) tạo thành trong phản ứng hoá học khi biết các khối lượng của các chất khác trong phản ứng.
Trong phản ứng hoá học ở thí nghiệm 1, biết khối lượng của $BaC{l_2}$ (Barium chloride) và $N{a_2}S{O_4}$ (Sodium sulfate) đã tham gia phản ứng lần lượt là 20,8 gam và 14,2 gam; khối lượng BaSO4 (Barium sulfate) tạo thành là 23,3 gam. Tính khối lượng của $NaCl$ (Sodium chloride) tạo thành..
Phương trình bảo toàn khối lượng của các chất trong phản ứng là:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride.
${m_{BaC{l_2}}} + {m_{N{a_2}S{O_4}}} = {m_{BaS{O_4}}} + {m_{NaCl}}$
$ \Rightarrow {m_{NaCl}} = {m_{BaC{l_2}}} + {m_{N{a_2}S{O_4}}} – {m_{BaS{O_4}}}$
$ \Leftrightarrow {m_{NaCl}} = 20,8 + 14,2 – 23,3 = 11,7\left( g \right)$
Vậy khối lượng của $NaCl$ (Sodium chloride) tạo thành sau phản ứng là 11,7 gam.
Chú ý: Nếu biết khối lượng của (n – 1) chất thì ta tính được khối lượng của chất còn lại. Với n là tổng số chất tham gia phản ứng và sản phẩm tạo thành.
III. Phương trình hóa học
– Phương trình hoá học là công thức hoá học của các chất tham gia phản ứng và sản phẩm tạo thành.
Ví dụ: $2{H_2}\; + \;{O_{2\;}} \to \;2\;{H_2}O$
– Các bước lập phương trình hoá học
✔ Viết sơ đồ phản ứng từ công thức hoá học của các chất tham gia và sản phẩm.
✔ So sánh số nguyên tử của mỗi nguyên tố trong các chất và cân bằng nếu cần thiết.
✔ Cân bằng số nguyên tử của mỗi nguyên tố bằng cách thêm hệ số phù hợp vào các chất.
✔ Kiểm tra và viết phương trình hoá học. Lưu ý cân bằng cả các nhóm nguyên tử không thay đổi trong phản ứng.
– Ý nghĩa của phương trình hoá học
✔ Cho biết các chất tham gia phản ứng hóa học và sản phẩm tạo thành sau phản ứng hóa học xảy ra.
✔ Cho biết tỉ lệ về số nguyên tử hay số phân tử giữa các chất trong phản ứng. Tỉ lệ này bằng đúng tỉ lệ hệ số của mỗi chất trong phương trình hóa học.
B. CÂU HỎI TRONG BÀI HỌC
Mở đầu trang 21 Bài 3 KHTN lớp 8: Quan sát hình 3.1:

Đặt hai cây nến trên đĩa cân, cân ở vị trí thăng bằng. Nếu đốt một cây nến, sau một thời gian, cân có còn thăng bằng không? Giải thích.
| Trả lời:
Đặt hai cây nến trên đĩa cân, cân ở vị trí thăng bằng. Nếu đốt một cây nến, sau một thời gian, cân không còn thăng bằng. Do cây nến bị đốt đã ngắn lại và không còn nặng như ban đầu. |
Luyện tập 1 trang 23 KHTN lớp 8: Tính khối lượng FeS tạo thành trong phản ứng của Fe và S, biết khối lượng của Fe và S đã tham gia phản ứng lần lượt là 7 gam và 4 gam.
| Trả lời:
Áp dụng định luật bảo toàn khối lượng: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng cùa các chất tham gia phản ứng. Vậy khối lượng FeS tạo thành = khối lượng Fe phản ứng + khối lượng S phản ứng = 7 + 4 = 11 gam. |
Vận dụng 1 trang 23 KHTN lớp 8: Trở lại thí nghiệm trong hoạt động mở đầu: Cân có còn giữ ở vị trí thăng bằng không? Giải thích.
| Trả lời:
Cân không còn giữ ở trạng thái cân bằng. Do nến cháy sinh ra khí carbon dioxide và hơi nước làm cây nến ngắn dần so với ban đầu. |
Vận dụng 2 trang 23 KHTN lớp 8: Giải quyết tình huống:
a) Khi đốt cháy hoàn toàn một mẩu gỗ, ta thu được tro có khối lượng nhẹ hơn mẩu gỗ ban đầu. Theo em, sự thay đổi khối lượng này có mâu thuẫn với định luật bảo toàn khối lượng không?
b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng định luật bảo toàn khối lượng trong tình huống trên.
| Trả lời:
a) Sự thay đổi khối lượng này không có mâu thuẫn với định luật bảo toàn khối lượng. Do sản phẩm thu được khi đốt cháy mẩu gỗ ngoài tro còn có carbon dioxide, hơi nước. b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng: Chuẩn bị: – Dụng cụ: Cân điện tử, bật lửa. – Hoá chất: Bình chứa khí oxygen, 1 que đóm có độ dài ngắn hơn chiều cao của bình chứa khí oxygen. Tiến hành: – Bước 1: Đặt bình tam giác có chứa khí oxygen và que đóm trên đĩa cân điện tử. Ghi chỉ số khối lượng hiện lên mặt cân (kí hiệu là mA). – Bước 2: Đốt một đầu que đóm và cho nhanh vào bình chứa khí oxygen, sau đó đậy nút lại. Sau khi que đóm cháy hết hoặc dừng cháy, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mB). – Bước 3: So sánh mA và mB, rút ra kết luận. |
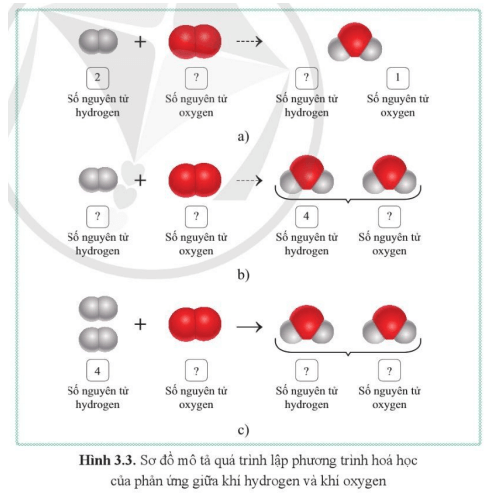
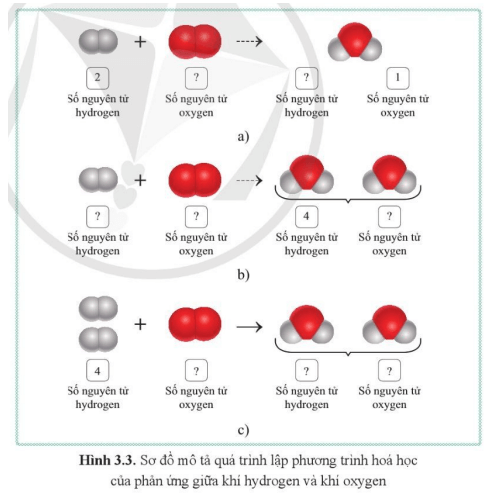
Câu hỏi 1 trang 24 KHTN lớp 8: Dựa vào kiến thức đã học, cho biết tổng số nguyên tử của mỗi nguyên tố tham gia và tạo thành sản phẩm trong ví dụ bên cần phải tuân theo nguyên tắc như thế nào?
| Trả lời:
Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm. |
Câu hỏi 2 trang 24 KHTN lớp 8: Cho biết số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng và các chất sản phẩm trong các ô trống trên hình 3.3.
| Trả lời:
|
Luyện tập 2 trang 25 KHTN lớp 8: Lập phương trình hoá học của phản ứng magnesium (Mg) tác dụng với oxygen (O2) tạo thành magnesium oxide (MgO).
| Trả lời:
Bước 1: Viết sơ đồ của phản ứng:$Mg\; + \;{O_2}\; – \; – \; – \; \to \;MgO$ Bước 2: So sánh số nguyên tử của mỗi nguyên tố có trong phân tử các chất tham gia phản ứng và các chất sản phẩm: $Mg\; + \;{O_2}\; – \; – \; – \; \to \;MgO\;$ Số nguyên tử: 1 2 1 1 Bước 3 + 4: Cân bằng số nguyên tử của mỗi nguyên tố, viết phương trình hoá học: $2Mg\; + \;{O_2}\; \to \;2MgO.\;\;\;\;\;\;$ |
Luyện tập 3 trang 25 KHTN lớp 8: Lập phương trình hoá học của phản ứng khi cho dung dịch sodium carbonate (Na2CO3) tác dụng với dung dịch calcium hydroxide (Ca(OH)2) tạo thành calcium carbonate (CaCO3) không tan (kết tủa) và sodium hydroxide (NaOH).
| Trả lời:
Bước 1: Viết sơ đồ phản ứng: $N{a_2}C{O_3}\; + \;Ca{\left( {OH} \right)_2}\; – \; – \; – \; \to \;CaC{O_3} \downarrow \; + \;NaOH$ Bước 2: So sánh số nguyên tử/ nhóm nguyên tử của mỗi nguyên tố/ chất trước và sau phản ứng. $N{a_2}C{O_3}\; + \;Ca{\left( {OH} \right)_2}\; – \; – \; – \; \to \;CaC{O_3} \downarrow \; + \;NaOH$ Số nguyên tử/ nhóm nguyên tử: 2 1 1 2 1 1 1 1 Bước 3: Cân bằng số nguyên tử/ nhóm nguyên tử: $N{a_2}C{O_3}\; + \;Ca{\left( {OH} \right)_2}\; – \; – \; – \; \to \;CaC{O_3} \downarrow \; + \;2NaOH$ Số nguyên tử/ nhóm nguyên tử: 2 1 1 2 1 1 2 2 Bước 4: Kiểm tra và viết phương trình hoá học: $N{a_2}C{O_3}\; + \;Ca{\left( {OH} \right)_2}\; \to \;CaC{O_3} \downarrow \; + \;2NaOH$ |
Luyện tập 4 trang 26 KHTN lớp 8: Xét phương trình hoá học của phản ứng sau: 4Al + 3O2 → 2Al2O3
a) Cho biết số nguyên tử, số phân tử của các chất tham gia phản ứng và các chất sản phẩm.
b) Cho biết tỉ lệ hệ số của các chất trong phương trình hoá học.
| Trả lời:
a) Số nguyên tử Al : Số phân tử O2 : Số phân tử $A{l_2}{O_3}$ = 4 : 3 : 2. b) Tỉ lệ hệ số của các chất trong phương trình hoá học = 4 : 3 : 2. |
Vận dụng 3 trang 26 KHTN lớp 8: Trong dạ dày người có một lượng hydrochloric acid (HCl) tương đối ổn định, có tác dụng trong tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (NaHCO3) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
$NaHC{O_3}\; + \;HCl\; \to \;NaCl\; + \;{H_2}O\; + \;C{O_2} \uparrow {\;^*}$
Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
| Trả lời:
Một số thực phẩm có thể gây tăng lượng acid có trong dạ dày: – Đồ ăn chua: Quả chua như chanh, quất … và đồ ăn lên men như dưa muối, cà muối … là những thực phẩm có lượng acid cao, khi xuống đến dạ dày có thể làm tăng lượng acid có trong dạ dày. – Nước uống có gas: Các loại nước uống có gas phổ biến như Pepsi và Coca – cola có giá trị pH khoảng 2,5 – 3,5, do đó chúng cũng làm tăng lượng acid có trong dạ dày. – Đồ ăn giàu chất béo: Chất béo tồn tại lâu hơn trong dạ dày và khiến tăng tiết acid dạ dày liên tục trong suốt quá trình co bóp để tiêu hóa. – Đồ ăn cay nóng: Đồ ăn cay nóng cũng được liệt vào danh sách những thực phẩm người bị đau dạ dày không nên ăn. Gia vị cay nóng có thể khiến cho dạ dày bị tổn thương, làm tình trạng dư thừa acid dạ dày càng trở nên trầm trọng. Ngoài ra, bia, rượu và các đồ uống có cồn cũng góp phần làm tăng lượng acid có trong dạ dày. |
C. CÂU HỎI CUỐI BÀI HỌC
KHÔNG CÓ
D. TỰ LUẬN
Bài 1. Đốt cháy 3,2 g Sulfur (lưu huỳnh) S trong không khí thu được 6,4 g sulfur dioxide. Tính khối lượng của oxygen đã phản ứng.
| Trả lời:
Áp dụng định luật bảo toàn khối lượng: ${m_S} + \;{m_{{O_2}}} = \;{m_{S{O_2}}}$ => ${m_{{O_2}}} = \;{m_{S{O_2}}}–\;{m_S} = \;6,4\; – 3,2\; = \;3,2\;gam$ |
Bài 2: Lập PTHH của các phản ứng sau:
a) Phosphorus$\left( S \right)$ + khí Oxygen$\left( {{O_2}} \right)$ → Phosphorus(V)oxide$\left( {{P_2}{O_5}} \right)$
b) Khí hydrogen $\left( {{H_2}} \right)$+ oxide sắt từ $\left( {F{e_3}{O_4}} \right)$→ Sắt ($Fe$)+ Nước $\left( {{H_2}O} \right)$
c) Calcium carbonate (CaCO3) + hydrochloric acid (HCl) → Calcium chloride (CaCl2) + nước $\left( {{H_2}O} \right)$ + khí carbonic $\left( {C{O_2}} \right)$
| Trả lời:
a) Phosphorus$\left( S \right)$ + khí Oxygen$\left( {{O_2}} \right)$ → Phosphorus(V)oxide$\left( {{P_2}{O_5}} \right)$ $4P\; + \;5{O_2} \to 2{P_2}{O_5}$ b) Khí hydrogen $\left( {{H_2}} \right)$+ oxide sắt từ $\left( {F{e_3}{O_4}} \right)$→ Sắt ($Fe$)+ Nước $\left( {{H_2}O} \right)$ $4{H_2} + \;F{e_3}{O_4} \to 3Fe\; + \;4{H_2}O$ a) Calcium carbonate (CaCO3) + hydrochloric acid (HCl) → Calcium chloride (CaCl2) + nước $\left( {{H_2}O} \right)$ + khí carbonic $\left( {C{O_2}} \right)$ $CaC{O_3} + \;HCl \to CaC{l_2} + \;{H_2}O\; + \;C{O_2}$ |
Bài 3. Trong phản ứng hóa học: barium chloride + sodium sulfate → barium sulfate + sodium chloride. Cho biết khối lượng của sodium sulfate Na2SO4 là 14,2 gam, khối lượng của barium sufate BaSO4 và sodium chloride NaCl lần lượt là: 23,3 g và 11,7 g. Hãy tính khối lượng của barium chloride BaCl2 đã phản ứng?
| Trả lời:
$BaC{l_2} + \;N{a_2}S{O_4} \to BaS{O_4} \downarrow + \;2NaCl$ Áp dụng định luật bảo toàn khối lượng: ${m_{BaCl2}} + \;{m_{Na2SO4}} = \;{m_{BaSO4}} + \;{m_{NaCl}}$ $ \Rightarrow \;{m_{BaC{l_2}}} = \;{m_{BaS{O_4}}} + \;{m_{NaCl}}–\;{m_{N{a_2}S{O_4}}} = \;23,3\; + \;11,7\;–\;14,2\; = \;20,8\;\left( g \right)$ |
Bài 4. Đốt cháy m g kim loại Magnesium Mg trong không khí thu được 8g hợp chất Magnesium oxide (MgO). Biết rằng khối lượng Magnesium Mg tham gia bằng 1,5 lần khối lượng của oxygen (không khí) tham gia phản ứng.
a. Viết phản ứng hóa học.
b. Tính khối lượng của Mg và oxygen đã phản ứng.
| Trả lời:
a. $2Mg\; + \;{O_2} \to 2MgO$ b. Áp dụng định luật bảo toàn khối lượng: ${m_{Mg}} + \;{m_{{O_2}}} = \;{m_{MgO}}$ => $1,5\;{m_{{O_2}}} + \;{m_{{O_2}}} = \;{m_{MgO}}\left( {Vì\,\;{m_{Mg}} = \;1,5.{m_{{O_2}}}} \right)$ => ${m_{O2}} = \;\frac{8}{{2,5}}\; = \;3,2\;\left( g \right)$ Vậy ${m_{Mg}} = \;1,5.{m_{O2}} = \;1,5.3,2\; = \;4,8\;\left( g \right)$ |
Bài 5. Đá đôlomit (là hỗn hợp của CaCO3 và MgCO3), khi nung nóng đá này tạo ra 2 oxide là Calcium oxide CaO và Magnesium oxide MgO và thu được khí carbon dioxide.
a. Viết phản ứng hóa học xảy ra và phương trình khối lượng nung đá đôlomit.
b. Nếu nung đá đôlomit, sau phản ứng thu được 88 kg khí carbon dioxide và 104 kg hai oxide các loại thì phải dùng khối lượng đá đôlomit là:
A. 150kg B. 16kg C. 192kg D. Kết quả khác.
| Trả lời:
a. $CaC{O_3}\;\quad {t^0}\quad \to CaO\; + \;C{O_2}$ b. $MgC{O_3}\quad {t^0}\quad \to \;MgO\; + \;C{O_2}$ Phương trình tính khối lượng : ${m_{đolomit}} = \;{m_{oxide}} + \;{m_{C{O_2}}}$ b. Ta có: ${m_{đolomit}} = \;{m_{oxide}} + \;{m_{C{O_2}}}$ $ \Leftrightarrow {m_{đolomit}} = \;104 + 88 = 192\left( {kg} \right)$ Đáp án C |
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1: Điền vào chỗ trống: “Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm … tổng khối lượng của các chất phản ứng.”
A. lớn hơn B. nhỏ hơn C. bằng D. nhỏ hơn hoặc bằng
Câu 2: Sơ đồ phản ứng hóa học của các chất: A + B ⇒ C + D. Phương trình bảo toàn khối lượng là:
A. ${m_A} + \;{m_C} = \;{m_B} + \;{m_D}$ B. ${m_A} + \;{m_D} = \;{m_C} + \;{m_B}$
C. ${m_A} + \;{m_B} = \;{m_C} + \;{m_D}$ D. ${m_A} + \;{m_B} = \;{m_C} – \;{m_D}$
Câu 3: Trong một phản ứng có n chất (bao gồm cả chất phản ứng và chất sản phẩm), nếu biết khối lượng của bao nhiêu chất thì có thể tính được khối lượng của chất còn lại?
A. n −3 B. n – 2 C. n – 4 D. n – 1
Câu 4: Định luật bảo toàn khối lượng do những nhà khoa học nào tìm ra?
A. Lomonosov và Mendeleev B. Mendeleev và Lavoisier
C. Pasteur và Mendeleev D. Lomonosov và Lavoisier
Câu 5: Có mấy bước lập phương trình hóa học?
A. 5 B. 6 C. 3 D. 4
Câu 6: Cho sơ đồ phản ứng hóa học dạng chữ:
Acetic acid + Sodium hydrogencarbonate → Sodium acetate + Carbon dioxide (khí) + Nước
Áp dụng định luật bảo toàn khối lượng cho sơ đồ trên.
A. mAcetic acid + mSodium hydrogencarbonate = mSodium acetate – mCarbon dioxide – mNước
B. mAcetic acid + mSodium hydrogencarbonate = mSodium acetate – mCarbon dioxide + mNước
C. mAcetic acid + mSodium hydrogencarbonate = mSodium acetate + mCarbon dioxide – mNước
D. mAcetic acid + mSodium hydrogencarbonate = mSodium acetate + mCarbon dioxide + mNước
Câu 7: Khẳng định nào dưới đây không đúng?
A. Lập phương trình hóa học gồm có 3 bước cơ bản.
B. Phương trình hóa học biểu diễn ngắn gọn phản ứng hóa học.
C. Sơ đồ phản ứng chính là phương trình hóa học.
D. Ý nghĩa của phương trình hóa học cho biết lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng cũng như giữa từng cặp chất trong phản ứng.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| C | A | D | D | D | D |
C |
MỨC ĐỘ 2 : HIỂU (5 câu)
Câu 8: Một vật thể bằng sắt để ngoài trời, sau một thời gian bị gỉ. Hỏi khối lượng của vật thay đổi thế nào so với khối lượng của vật trước khi gỉ?
A. Tăng B. Giảm
C. Không thay đổi D. Không thể biết
 Hướng dẫn giải
Hướng dẫn giải
Sắt phản ứng với Oxygen tạo thành gỉ sắt chính là oxide của Sắt nên khối lượng sẽ tăng.
Câu 9: Cho biết tỉ lệ giữa các chất tham gia phản ứng trong phương trình sau:
$Ba{\left( {OH} \right)_2}\; + \;CuS{O_4}\; \to \;Cu{\left( {OH} \right)_2}\; + \;BaS{O_4} \downarrow $
A. 1 : 1 B. 1 : 2 C. 2 : 1 D. 2 : 3
Câu 10: Nung đá vôi thu được sản phẩm là vôi sống và khí Carbon dioxide. Kết luận nào sau đây là đúng?
A. Khối lượng đá vôi đem nung bằng khối lượng vôi sống tạo thành.
B. Khối lượng đá vôi bằng khối lượng khí Carbon dioxide sinh ra.
C. Khối lượng đá vôi bằng khối lượng khí Carbon dioxide cộng với khối lượng vôi sống.
D. Sau phản ứng khối lượng đá vôi tăng lên.
 Hướng dẫn giải:
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng:
Khối lượng đá vôi = khối lượng vôi sống + khối lượng khí Carbon dioxide
Câu 11: Điền vào chỗ trống: $…Al\; + \;…{O_2}\; \to \;…A{l_2}{O_3}$
A. 2, 3, 1 B. 4, 3, 2 C. 4, 2, 3 D. 2, 3, 2
Câu 12: $CaC{O_3}\; + \;X\; \to \;CaC{l_2}\; + \;C{O_2}\; + \;{H_2}O$. X là?
A. HCl B. Cl2 C. H2 D. HO
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| A | A | C | B |
A |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 13: Cho một thanh nhôm tác dụng với dung dịch hydrochloric acid thu được 26,7 gam muối nhôm và thấy có 0,6 gam khí hydrogen thoát ra. Tổng khối lượng của các chất phản ứng là:
A. 26 gam B. 27,3 gam C. 26,1 gam D. 25,5 gam
| Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng: ${m_{Al}} + \;{m_{HCl}} = \;{m_{AlC{l_3}}} + \;{m_{{H_2}}}$ $ = > \;{m_{Al}} + \;{m_{HCl}} = \;26,7\; + \;0,6\; = \;27,3\;\left( g \right)$ |
Chọn B
Câu 14: Lưu huỳnh cháy theo sơ đồ phản ứng sau:
Lưu huỳnh + khí oxyen → Lưu huỳnh dioxide
Nếu đốt cháy 48 gam lưu huỳnh và thu được 96 gam lưu huỳnh dioxide thì khối lượng oxygen đã tham gia vào phản ứng là:
A. 40 gam B. 44 gam C. 48 gam D. 52 gam
| Hướng dẫn giải:
Lưu huỳnh + khí oxyen → Lưu huỳnh dioxide Áp dụng định luật bảo toàn khối lượng: ${m_S} + \;{m_{{O_2}}} = \;{m_{S{O_2}}}$ => ${m_{{O_2}}} = \;96\; – 48\; = \;48\;\left( g \right)$ |
Chọn C
Câu 15: Cho 13,2 gam hỗn hợp Magnesium, Iron (Sắt), Zinc (Kẽm) cháy trong khí Oxygen, thu được 8 gam hỗn hợp chất rắn. Khối lượng Oxygen tham gia phản ứng là
A. 3,2 gam B. 4,8 gam C. 9,6 gam. D. 12,8 gam
| Hướng dẫn giải:
Magnesium, Iron, Zic + khí Oxyen → Hỗn hợp rắn Áp dụng định luật bảo toàn khối lượng: ${m_{Magnesium,\;Iron,\;Zic}} + \;{m_{Oxygen}} = \;{m_{hh}}$ => ${m_{Oxygen}} = \;{m_{hh\;}} – \;{m_{Magnesium,\;Iron,\;Zic}} = \;18\;–\;13,2\; = \;4,8\;\left( g \right)$ |
Chọn B