- Chuyên Đề KHTN 8 Cánh Diều Bài Mở Đầu
- Chuyên Đề KHTN 8 Cánh Diều Bài 1 Biến Đổi Vật Lí Và Biến Đổi Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 2 Phản Ứng Hóa Học Và Năng Lượng Của Phản Ứng Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 3 Định Luật Bảo Toàn Khối Lượng Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 4 Mol Và Tỉ Khối Của Chất Khí
- Chuyên Đề KHTN 8 Cánh Diều Bài 5 Tính Theo Phương Trình Hóa Học
- Chuyên Đề KHTN 8 Cánh Diều Bài 6 Nồng Độ Dung Dịch
- Chuyên Đề KHTN 8 Cánh Diều Bài 7 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Cánh Diều Bài 8 Acid
- Chuyên Đề KHTN 8 Cánh Diều Bài 9 Base
- Chuyên Đề KHTN 8 Cánh Diều Bài 10 Thang pH
- Chuyên Đề KHTN 8 Cánh Diều Bài 11 Oxide
- Chuyên Đề KHTN 8 Cánh Diều Bài 12 Muối
- Chuyên Đề KHTN 8 Cánh Diều Bài 13 Phân Bón Hóa Học
Chuyên đề KHTN 8 Cánh diều bài 7 Tốc độ phản ứng và chất xúc tác được soạn dưới dạng file word và PDF gồm 7 trang. Các bạn xem và tải về ở dưới.
BÀI 7: TỐC ĐỘ PHẢN ỨNG VÀ CHẤT XÚC TÁC
SGK CÁNH DIỀU
A. TÓM TẮT LÝ THUYẾT
I. Tốc độ phản ứng hóa học là gì?
– Tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hoá học.
– Phản ứng hoá học xảy ra với những tốc độ rất khác nhau, có phản ứng xảy ra rất nhanh như phản ứng đốt cháy và phản ứng xảy ra rất chậm như sự gỉ sắt.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
– Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học bao gồm: diện tích bề mặt tiếp xúc, nhiệt độ, nồng độ, sự có mặt của chất xúc tác và chất ức chế.
– Diện tích bề mặt tiếp xúc: Diện tích bề mặt tiếp xúc của chất rắn càng lớn, tốc độ phản ứng càng nhanh.
– Nhiệt độ: Tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn.
– Nồng độ ảnh hưởng đến tốc độ phản ứng hoá học: Nếu nồng độ càng cao, tốc độ phản ứng càng nhanh.
– Chất xúc tác và ức chế:
Chất xúc tác tăng tốc độ phản ứng, không bị thay đổi (cả về chất và lượng) sau phản ứng.
Chất ức chế làm giảm tốc độ phản ứng. Các chất bảo quản là loại chất ức chế được sử dụng trong thực phẩm để ngăn ngừa sự thối rữa hay hư hỏng.
B. CÂU HỎI TRONG BÀI HỌC
Câu 1. [CD – SGK trang 41]: Tiến hành thí nghiệm sau để tìm hiểu về tốc độ của phản ứng hoá học:
Thí nghiệm 1
Cho một thìa thuỷ tinh bột đá vôi và một mẩu đá vôi nhỏ có khối lượng bằng nhau lần lượt vào hai ống nghiệm 1 và 2, sau đó cho đồng thời vào mỗi ống nghiệm khoảng 5 ml dung dịch HCl cùng nồng độ. Quan sát hiện tượng xảy ra ở hai ống nghiệm và trả lời các câu hỏi sau:
a) So sánh tốc độ tan của đá vôi trong dung dịch acid ở cả hai ống nghiệm.
b) Dựa vào đâu để kết luận phản ứng nào xảy ra nhanh hơn?
| Hướng dẫn giải
a) Đá vôi dạng bột (trong ống nghiệm 1) tan nhanh hơn đá vôi dạng viên (trong ống nghiệm 2). b) Dựa vào tốc độ tan của đá vôi trong dung dịch acid để kết luận phản ứng nào xảy ra nhanh hơn. |
Câu 2. [CD – SGK trang 41]: Quan sát hình 7.1 và cho biết phản ứng nào xảy ra nhanh hơn, phản ứng nào xảy ra chậm hơn.

| Hướng dẫn giải
Phản ứng đốt cháy cồn xảy ra nhanh hơn sự gỉ của sắt. |
Câu 3. [CD – SGK trang 42]: Trường hợp nào có phản ứng xảy ra với tốc độ nhanh hơn trong hai trường hợp sau:
a) Để que đóm còn tàn đỏ ở ngoài không khí.
b) Đưa que đóm còn tàn đỏ vào bình chứa khí oxygen.
Hướng dẫn giải
Trường hợp (b) Đưa que đóm còn tàn đỏ vào bình chứa khí oxygen có phản ứng xảy ra với tốc độ nhanh hơn.
Câu 4. [CD – SGK trang 42]: Trong hai phản ứng sau, phản ứng nào có tốc độ nhanh hơn, phản ứng nào có tốc độ chậm hơn?
a) Đốt cháy dây sắt trong oxygen.
b) Sự gỉ sắt trong không khí.
| Hướng dẫn giải
Phản ứng (a) có tốc độ nhanh hơn phản ứng (b). |
Câu 5. [CD – SGK trang 42]: Kể thêm hai phản ứng, một phản ứng có tốc độ nhanh và một phản ứng có tốc độ chậm trong thực tế.
| Hướng dẫn giải
– Phản ứng có tốc độ nhanh: Phản ứng đốt cháy khí gas dùng trong đun nấu. – Phản ứng có tốc độ chậm: Phản ứng lên men giấm. |
Câu 6. [CD – SGK trang 42]: Cho cùng một lượng Zn hạt và Zn bột vào hai ống nghiệm 1 và 2. Sau đó, cho cùng một thể tích dung dịch HCl dư cùng nồng độ vào hai ống nghiệm. Dự đoán lượng Zn ở ống nghiệm nào sẽ tan hết trước.
| Hướng dẫn giải
Dự đoán Zn ở ống nghiệm 2 (Zn dạng bột) sẽ tan hết trước do diện tích tiếp xúc với dung dịch HCl của Zn dạng bột lớn hơn của Zn dạng hạt. |
Câu 7. [CD – SGK trang 42]: Nêu ví dụ trong thực tiễn có vận dụng yếu tố ảnh hưởng của diện tích bề mặt tiếp xúc đến tốc độ của phản ứng.
| Hướng dẫn giải
Một số ví dụ: – Tạo các hàng lỗ trong viên than tổ ong để tăng diện tích tiếp xúc giữa than và không khí, cung cấp đủ oxygen cho quá trình cháy.
– Để nung đá vôi thành vôi sống được nhanh hơn, người ta tiến hành đập nhỏ đá vôi. – Thanh củi được chẻ nhỏ hoặc than được đập nhỏ trước khi đem nhóm bếp. |
Câu 8. [CD – SGK trang 42]: Giả sử nếu cắt một khối lập phương A (có cạnh là 4 cm) thành các phần bằng nhau (B) (gồm 8 khối lập phương có cạnh là 2 cm). Tính diện tích toàn phần bề mặt của A và B và rút ra kết luận.
| Hướng dẫn giải
Áp dụng công thức tính diện tích toàn phần hình lập phương: Stoàn phần = 6 × s2 Trong đó: s là độ dài 1 cạnh của hình lập phương. – Diện tích toàn phần bề mặt của A là: S toàn phần A = 6 × 42 = 96 (cm2). – Diện tích toàn phần bề mặt của B (gồm 8 khối lập phương nhỏ) là: S toàn phần B = 8 × 6 × 22 = 192 (cm2). Kết luận: Nếu chia một vật thành nhiều phần nhỏ hơn thì tổng diện tích bề mặt sẽ tăng lên. Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh. |
Câu 9. [CD – SGK trang 43]: Thực hành 2
Chuẩn bị:
● Dụng cụ: Ống nghiệm, đèn cồn, kẹp ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch H2SO4 1 M, đinh sắt.
Tiến hành:
● Cho lần lượt một chiếc đinh sắt nhỏ vào ống nghiệm 1 và 2, sau đó rót từ từ vào mỗi ống nghiệm khoảng 5 ml dung dịch H2SO4 1 M. Đun nóng ống nghiệm 1.
● Mô tả hiện tượng xảy ra trong hai ống nghiệm và so sánh tốc độ phản ứng.
● Nhận xét ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
| Hướng dẫn giải
– Hiện tượng xảy ra ở mỗi ống nghiệm: Đinh sắt tan dần, có khí thoát ra. Tốc độ khí thoát ra ở ống nghiệm (1) nhanh hơn so với ở ống nghiệm (2), suy ra tốc độ phản ứng ở ống nghiệm (1) nhanh hơn. – Nhận xét: Nhiệt độ có ảnh hưởng đến tốc độ của phản ứng hoá học. Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn. |
Câu 10. [CD – SGK trang 43]: Cho hai cốc thuỷ tinh đựng nước lạnh và nước nóng, thả đồng thời vào mỗi cốc một viên vitamin C (dạng sủi). Dự đoán xem ở cốc nào viên vitamin C tan nhanh hơn.
| Hướng dẫn giải
Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn. Dự đoán ở cốc nước nóng viên vitamin C tan nhanh hơn. |
Câu 11. [CD – SGK trang 43]: Tại sao trên các tàu đánh cá, ngư dân phải chuẩn bị những hầm chứa đá lạnh để bảo quản cá?
| Hướng dẫn giải
Hải sản sau khi đánh bắt trên tàu, thuyền cần được bảo quản để tránh hư hỏng, thối rữa gây giảm năng suất trong khi đợi đưa về đất liền để tiêu thụ. Do đó, trên các tàu đánh cá, ngư dân phải chuẩn bị những hầm chứa đá lạnh để bảo quản cá bằng cách ướp lạnh, giúp cá tươi lâu, làm chậm quá trình hư hỏng, phân huỷ cá… |
Câu 12. [CD – SGK trang 44]: Vào năm 1991, các nhà khoa học đã phát hiện ra xác ướp Otzi (Ốt – tờ – zi) – xác ướp tự nhiên được tìm thấy trong tuyết lạnh (có niên đại cách đây 5 300 năm) trên dãy núi Alps (An – pơ) gần biên giới giữa Áo và Italy.
Vì sao xác ướp này không cần đến hoá chất mà vẫn giữ nguyên vẹn hình thể?

| Hướng dẫn giải
Tuyết lạnh có nhiệt độ rất thấp, nhiệt độ này gây ức chế sự phát triển của các vi sinh vật phân hủy xác ướp. Vì vậy quá trình phân huỷ xác cũng bị ức chế nên xác ướp không cần đến hoá chất mà vẫn giữ nguyên vẹn hình thể. |
Câu 13. [CD – SGK trang 44]: Đề xuất thí nghiệm cho đá vôi tác dụng với dung dịch HCl để chứng minh nồng độ có ảnh hưởng đến tốc độ phản ứng.
| Hướng dẫn giải
Đề xuất thí nghiệm: Chuẩn bị: – Dụng cụ: Ống nghiệm, giá để ống nghiệm, ống hút nhỏ giọt. – Hoá chất: Đá vôi dạng bột, dung dịch HCl 1 M; dung dịch HCl 2 M. Tiến hành: – Cho lần lượt 1 gam đá vôi dạng bột vào ống nghiệm 1 và 2. – Sau đó, cho vào ống nghiệm 1 khoảng 5 mL HCl 1 M; cho vào ống nghiệm 2 khoảng 5 mL dung dịch HCl 2 M. – Ghi lại thời gian bột đá vôi tan hết ở mỗi ống nghiệm (hoặc so sánh tốc độ thoát khí ở mỗi ống nghiệm) và rút ra nhận xét về ảnh hưởng của nồng độ đến tốc độ phản ứng. |
Câu 14. [CD – SGK trang 44]:
Thực hành 3
Chuẩn bị:
● Dụng cụ: Ống nghiệm, kẹp ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch HCl 5%, dung dịch HCl 10%, Zn viên.
Tiến hành:
● Lần lượt cho vào mỗi ống nghiệm 1 và ống nghiệm 2 ba viên Zn có kích thước tương đương nhau. Sau đó, cho vào ống nghiệm 1 khoảng 5 ml dung dịch HCl 5%, ống nghiệm 2 khoảng 5 ml dung dịch HCl 10%.
● So sánh lượng bọt khí thoát ra ở hai ống nghiệm.
● Nhận xét ảnh hưởng của nồng độ đến tốc độ phản ứng.
| Hướng dẫn giải
– Lượng bọt khí ở ống nghiệm 2 (chứa HCl 10%) thoát ra nhanh và mạnh hơn. – Nhận xét: Nồng độ có ảnh hưởng đến tốc độ của phản ứng hoá học. Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng nhanh. |
Câu 15. [CD – SGK trang 44]: Thí nghiệm 4
Cho vào 2 bình tam giác (1), (2) mỗi bình khoảng 10mL dung dịch Hydrogen peroxide (H2O2). Sau đó cho vào bình một lượng nhỏ bột manganese dioxide (MnO2) có màu đen, nhận thấy bọt khí oxygen (O2) ở hai bình thoát ra thật nhanh và mạnh, trong khi bình (1) hầu như không thấy khí oxygen thoát ra. Sau phản ứng thấy bột manganese dioxide (MnO2) vẫn còn nguyên trong bình manganese dioxide được gọi là chất xúc tác cho phản ứng phân hủy hydrogen peroxide.
Trong thí nghiệm 4, cho biết MnO2 làm thay đổi tốc độ phản ứng như thế nào?
| Hướng dẫn giải
Trong thí nghiệm 4, MnO2 làm tăng tốc độ phản ứng. |
Câu 16. [CD – SGK trang 45]: Khi điều chế oxygen trong phòng thí nghiệm từ KClO3, phản ứng xảy ra nhanh hơn khi có MnO2. Cho biết vai trò của MnO2 trong phản ứng này.
| Hướng dẫn giải
MnO2 là chất xúc tác cho phản ứng điều chế oxygen từ KClO3. |
Câu 17. [CD – SGK trang 45]: Các enzyme tiêu hoá trong cơ thể là những chất xúc tác sinh học thúc đẩy các phản ứng sinh hoá phức tạp trong cơ thể chúng ta. Ví dụ, các enzyme protease, lipase và amylase trong cơ thể là các chất xúc tác giúp đẩy nhanh quá trình tiêu hoá chất đạm, chất béo và tinh bột. Hãy tìm hiểu khái niệm và vai trò của enzyme tiêu hoá.
| Hướng dẫn giải
– Khái niệm enzyme: Enzyme là chất xúc tác sinh học đặc hiệu làm tăng tốc độ phản ứng, không bị biến đổi khi kết thúc phản ứng. – Vai trò của enzyme tiêu hóa: Enzyme tiêu hóa có vai trò xúc tác cho các phản ứng phân giải các chất trong thức ăn (tinh bột, chất đạm, chất béo,…) thành các chất dinh dưỡng mà cơ thể có thể hấp thu được. Như vậy, nhờ sự hoạt động của enzyme tiêu hóa, quá trình tiêu hóa thức ăn được diễn ra với tốc độ nhanh chóng, đáp ứng kịp thời nhu cầu dinh dưỡng của cơ thể. |
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. TỰ LUẬN
Câu 1: Quan sát hình dưới đây và cho biết phản ứng nào xảy ra nhanh hơn, phản ứng nào xảy ra chậm hơn.


a) Than cháy b) Tinh bột lên men rượu
| Hướng dẫn giải
Phản ứng than cháy xảy ra nhanh hơn tinh bột lên men rượu. |
Câu 2: Cho hai mảnh Mg có cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl ở mỗi ống nghiệm là 2M và 0,5M như hình vẽ dưới đây. Dự đoán lượng Mg ở ống nghiệm nào sẽ tan hết trước.

Hướng dẫn giải
Dự đoán Mg ở ống nghiệm a sẽ tan hết trước do nồng độ dung dịch HCl ở ống nghiệm a lớn hơn nồng độ dung dịch HCl ở ống nghiệm b.
Câu 3: Trong hai phản ứng sau, phản ứng nào có tốc độ nhanh hơn, phản ứng nào có tốc độ chậm hơn?
a) Đốt cháy cồn.
b) Phản ứng lên men đường thành rượu.
| Hướng dẫn giải
Phản ứng (a) có tốc độ nhanh hơn phản ứng (b). |
Câu 4: Tại sao thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn?
| Hướng dẫn giải
Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn ⇒ Ảnh hưởng của nhiệt độ đến tốc độ phản ứng. |
Câu 5: Tiến hành thí nghiệm sau và so sánh tốc độ khí thoát ra trong hai bình tam giác.
Thí nghiệm
Hóa chất: Dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.
Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.
Tiến hành:
Bước 1: Cân khoảng 2 g CaCO3 dạng khối vào bình tam giác (1) và dạng hạt nhỏ cho vào bình tam giác (2)
Bước 2: Đong khoảng 20 mL dung dịch HCl, rót đồng thời vào mỗi bình tam giác.
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
● So sánh lượng bọt khí thoát ra ở hai ống nghiệm.
● Nhận xét ảnh hưởng của diện tích bề mặt đá vôi (CaCO3) đến tốc độ phản ứng.
| Hướng dẫn giải
– Lượng bọt khí ở ống nghiệm 1 (chứa CaCO3 dạng hạt nhỏ) thoát ra nhanh và mạnh hơn. – Nhận xét: Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh. |
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng.
B. Độ tan.
C. Nồng độ phần trăm các chất trong dung dịch.
D. Tỉ khối của chất khí.
Câu 2. Diện tích bề mặt tiếp xúc của _____________càng lớn, tốc độ phản ứng càng nhanh.
A. chất lỏng. B. chất rắn. C. chất khí. D. chất tan.
Câu 3. Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ?
A. giảm xuống. B. tăng lên. C. lúc tăng lúc giảm. D. không đổi.
Câu 4. Khi giảm nồng độ của một chất tham gia phản ứng, phản ứng diễn ra với tốc độ?
A. tăng lên. B. không đổi. C. lúc tăng lúc giảm. D. giảm xuống.
Câu 5. Các phản ứng khác nhau thì
A. tốc độ phản ứng khác nhau.
B. tốc độ phản ứng vẫn giống nhau.
C. tốc độ phản ứng khác nhau không đáng kể.
D. tốc độ phản ứng chỉ khác nhau khi có chất khí tham gia.
Câu 6. Các chất bảo quản là loại_______được sử dụng trong thực phẩm để ngăn ngừa sự thối rữa hay hư hỏng. Đáp án phù hợp nhất điền vào chỗ trống là
A. chất ức chế. B. chất xúc tác.
C. chất tan trong dung dịch. D. chất không tan trong dung dịch.
Câu 7. Chất xúc tác là chất ___________
A. làm tăng tốc độ phản ứng không bị thay đổi cả về (chất và lượng) sau phản ứng.
B. làm giảm tốc độ phản ứng không bị thay đổi cả về (chất và lượng) sau phản ứng.
C. làm tăng tốc độ phản ứng bị thay đổi cả về (chất và lượng) sau phản ứng.
D. làm giảm tốc độ phản ứng bị thay đổi cả về (chất và lượng) sau phản ứng.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| A | B | B | D | A | A |
A |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 1. Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây.
A. Bề mặt tiếp xúc giữa các chất phản ứng.
B. Nồng độ các chất tham gia phản ứng.
C. Chất xúc tác.
D. Thời gian xảy ra phản ứng.
Câu 2. Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để lên men rượu?
A. Chất ức chế. B. Chất xúc tác. C. Nồng độ. D. Nhiệt độ.
Câu 3. Nung đá vôi ở nhiệt độ cao hơn để sản xuất vôi sống. Người ta đã lợi dụng yếu tố nào để tăng tốc độ phản ứng trên?
A. Chất ức chế. B. Nồng độ. C. Nhiệt độ. D. Chất xúc tác.
Câu 4. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây?
A. Dạng viên nhỏ. B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng. D. Dạng nhôm dây.
Câu 5. Trong hàn xì, để phản ứng đốt cháy acetylene xảy ra nhanh và cho nhiệt độ cao hơn, người ta dùng
A. oxygen trong không khí. B. oxygen nguyên chất.
C. hỗn hợp khí oxygen và khí nitrogen. D. hỗn hợp khí oxygen và carbon dioxide.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| D | B | C | B |
B |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 1. Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn?
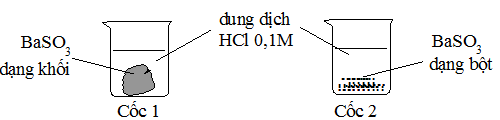
A. Cốc 1 tan nhanh hơn. B. Cốc 2 tan nhanh hơn.
C. Tốc độ tan ở 2 cốc như nhau. D. BaSO3 tan nhanh nên không quan sát được.
| Hướng dẫn giải
Sử dụng yếu tố diện tích tiếp xúc, Cốc 2: BaSO3 dạng bột sẽ làm tăng diện tích bề mặt tiếp xúc, tốc độ phản ứng xảy ra nhanh hơn. Chọn B. |
Câu 2. Có 3 cốc chứa 20ml dung dịch H2O2 cùng nồng độ. Tiến hành 3 thí nghiệm như hình vẽ sau.
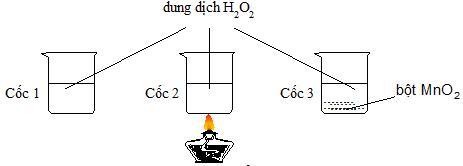
Ở thí nghiệm nào có bọt khí thoát ra chậm nhất?
A. Thí nghiệm 2. B. 3 thí nghiệm như nhau.
C. Thí nghiệm 3. D. Thí nghiệm 1.
| Hướng dẫn giải
TN2: sử dụng yếu tố nhiệt độ, TN3: sử dụng xúc tác MnO2. Chọn D. |
Câu 3.
| Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn (a), bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí (b). Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên. |  a) a) b) b) |
A. Nhiệt độ, xúc tác. B. Nhiệt độ, nồng độ.
C. Nhiệt độ, diện tích bề mặt tiếp xúc. D. Nồng độ, xúc tác.
Hướng dẫn giải
(a) Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn ⇒ Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
(b) Bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí ⇒ Ảnh hưởng của nồng độ đến tốc độ phản ứng.
Chọn B.









