- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 1 Sử Dụng Hóa Chất Dụng Cụ Và Các Thiết Bị Điện An Toàn
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 2 Biến Đổi Vật Lí Và Biến Đổi Hóa Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 3 Phản Ứng Hoá Học Và Năng Lượng Trong Các Phản Ứng
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 4 Định Luật Bảo Toàn Khối Lượng Và Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 5 Mol Và Tỉ Khối Của Chất Khí
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 6 Tính Theo Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 7 Nồng Độ Dung Dịch
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 8 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 9 Acid
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 10 Base
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 11 Thang pH
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 12 Oxide
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 13 Muối
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 14 Phân Bón Hóa Học
Chuyên đề KHTN 8 Chân trời sáng tạo bài 6 Tính theo phương trình hoá học được soạn dưới dạng file word và PDF gồm 6 trang. Các bạn xem và tải về ở dưới.
BÀI 6: TÍNH THEO PHƯƠNG TRÌNH HOÁ HỌC
A. TÓM TẮT LÝ THUYẾT
Để tính theo phương trình hó học, ta tiến hnfh theo các bước sau:
– Viết phương trình hoá học và xác định tỉ lệ số mol các chất trong phản ứng.
– Xác định số mol chất phản ứng hoặc chất tạo thành theo dữ kiện đề bài.
– Dựa vào phương trình hó học và lượng chất đã biết tim số mol chất còn lại.
– Chuyển đổi số mol chất thành khối lượng hoặc thể tích (đối với chất khí ở đkc) theo yêu cầu của đề bài.
Hiệu suất phản ứng cho biết khả năng phản ứng xảy ra đến mức độ nào, được tính bằng tỉ số giữa lượng sản phẩm thực tế và lượng sản phẩm theo lí thuyết
Công thức tính hiệu suất phản ứng:
Lượng lí thuyết và lượng thực tế lấy cùng đơn vị đo.
B. CÂU HỎI TRONG BÀI HỌC
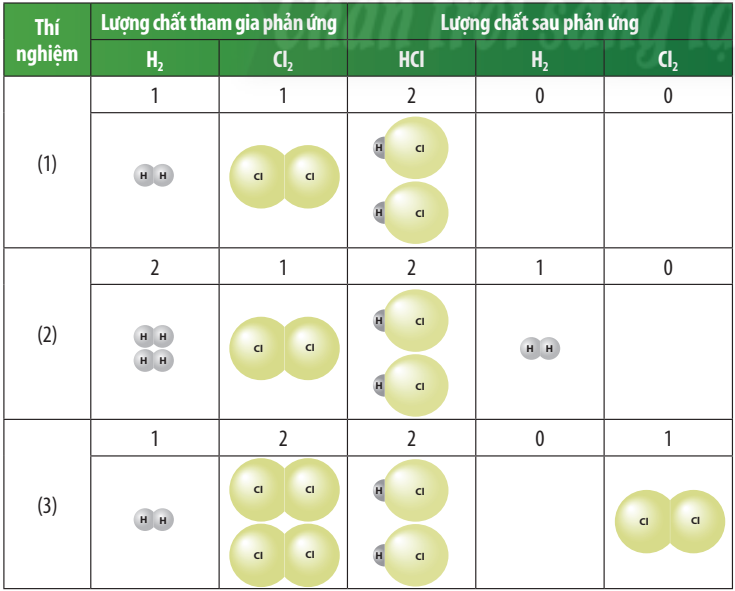
Bảng 6.1. Kết quả this nghiệm sử dụng tỉ lệ mol khác nhau của các chất tham gia phản ứng
Câu hỏi thảo luận
1. Các chất sau phản ứng trong các thí nghiệm (1), (2) và (3) gồm những chất nào?
2. Trong Thí nghiệm (2) và (3), chất nào là chất thiếu và chất nào là chát thiếu và chất nào là chất dư?
3. Phản ứng nào xảy ra vừa đủ trong các thí nghiệm (1), (2) và (3)?
4. Sản phẩm tạo thành trong 3 thí nghiệm (bảng 6.1) là chất nào? Để xác định lượng sản phẩm tạo thành cần dựa vào lượng chất thiếu hay chất dư?
5. Để tính được khối lượng vôi sống thu được sau khi nung ta thực hiện như thế nào?
6. Hãy trình bày cách tính thể tích khí chlorine đã tham gia phản ứng ở ví dụ 2.
Hướng dẫn giải
1. Các chất sau phản ứng trong thí nghiệm (1): 2 phân tử HCl; thí nghiệm (2): 2 phân tử HCl và 1 phân tử H2; thí nghiệm (3): 2 phân tử HCl và 1 phân tử Cl2
2. Trong thí nghiệm (2) chất thiếu là Cl2; chất dư là H2
Trong thí nghiệm (3) chất thiếu là H2; chất dư là Cl2.
3. Phản ứng xảy ra vừa đủ: thí nghiệm (1)
4. Sản phẩm tạo thành trong 3 thí nghiệm là là HCl. Để xác định lượng sản phẩm tạo thành cần dựa vào lượng chất thiếu.
5. Để tính đươc khối lượng vôi sống sau khi nung ta thực hiện các bước sau:
Bước 1: Viết phương trình hoá học và định tỉ lệ số mol các chất trong phản ứng.
Bước 2: Tìm số mol CaCO3 phản ứng.
Bước 3: Dựa vào phương trình hoá học tìm số mol CaO tạo thành.
Bước 4: Chuyển đổi số mol chất thành khối lượng.
Khối lượng này trên thực tế có thể xác định được bằng việc cân.
6. Cách tính thể tích khí chlorine đã tham gia phản ứng
Bước 1: Viết phương trình hoá học và xác định tỉ lệ các chất trong phản ứng.
Bước 2: Tìm số mol AlCl3 tạo thành sau phản ứng.
Bước 3: Dựa vào phương trình hoá học tìm số mol khí chlorine tham gia.
Bước 4: Chuyển đổi số mol chất thành thể tích.
Câu hỏi: Đốt cháy hoàn toàn 6,2 gam phosphorus trong khí oxygen. Hãy tính thể tích khí oxygen (đkc) và khối lượng sản phẩm tạo thành theo phản ứng: 4P + 5O2 → 2P2O5
Hướng dẫn giải
Bước 1: Phương trình hoá học: 4P + 5O2 → 2P2O5
4 : 5 : 2
Bước 2: ${n_P} = \frac{{{m_P}}}{{{M_P}}} = \frac{{6,2}}{{31}} = 0,2 $ (mol)
Bước 3: Theo tỉ lệ mol của phản ứng, ta có:
${n_{{O_2}}} = \frac{{{n_P} \times 5}}{4} = \frac{{0,2 \times 5}}{4} = 0,25 $(mol)
${n_{{P_2}O5}} = \frac{{{n_P} \times 2}}{4} = \frac{{0,2 \times 2}}{4} = 0,1 $ (mol)
Bước 4:
${V_{{O_2}}} = {n_{{O_2}}} \times 24,79 = 0,25 \times 24,79 = 6,1975{\text{ (l}}it) $
${m_{{P_2}{O_5}}} = {n_{{P_2}{O_5}}} \times {M_{{P_2}{O_5}}} = 0,1 \times 142 = 14,2{\text{ (}}gam) $
Câu hỏi thảo luận
7. Em có nhận xét gì về khối lượng thực tế và khối lượng lí thuyết thu được của mmmonia.
8. Để tính được hiệu suất phản ứng ta cần biết những thông tin gì?
Hướng dẫn giải
7. Khối lượng thực tế của ammonia nhỏ hơn khối lượng lí thuyết thu được.
8. Để tính được hiệu suất cần biết lượng sản phẩm thực tế và lượng sản phẩm lí thuyết.
Câu hỏi
Cho 0,50 mol khí hydrogen tác dụng với 0,45 mol hơi iodine thu được 0,60 mol khí hydrogen iodide. Tính hiệu suất phản ứng.
Hướng dẫn giải
Phương trình hoá học: H2 (g) + I2 (g) → 2HI (g)
Theo phương trình 1 1 2 (mol)
Theo đề bài 0,50 0,45 (mol)
Vì $\frac{{0,50}}{1} > \frac{{0,45}}{1} $ → H2 (g) còn dư; I2 (g) phản ứng hết
→ nHI (lí thuyết) = 0,45.2 = 0,90 (mol)
Vậy hiệu suất của phản ứng: $H\% = \frac{{0,60}}{{0,90}} \times 100\% = 66,67\% $
C. CÂU HỎI CUỐI BÀI HỌC
Không có
D.TỰ LUẬN
Câu 1: Cho 5,6 gam iron phản ứng vừa đủ với Hydrochloric acid (HCl), sau phản ứng thu được muối iron (II) chloride (FeCl2) và khí H2.
(a) Viết phương trình hóa học xảy ra
(b) Tính khối lượng muối iron (II) chloride thu được.
(c) Tính thể tích khí hydrogen thu được ở đkc.
Hướng dẫn giải
(a) Phương trình hoá học: Fe + 2HCl → FeCl2 + H2
Theo phương trình 1 2 1 1 (mol)
(b) ${n_{Fe}} = \frac{{5,6}}{{56}} = 0,1{\text{ (mol)}} $
Theo phương trình: nFeCl2 = nFe = 0,1 (mol)
Vậy mFeCl2 = 0,1.127 = 12,7 (gam)
(c) Theo phương trình: nH2 = nFe = 0,1 (mol)
Vậy VH2 = 0,1.24,79 = 2,479 (lít)
Câu 2: Đốt cháy m gam magnesium trong oxygen dư thu được 8 gam magnesium oxide (MgO).
(a) Viết phương trình hóa học xảy ra.
(b) Tính khối lượng magnesium đã tham gia phản ứng.
(c) Tính thể tích khí oxygen cần dùng (ở đkc) theo 2 cách.
Hướng dẫn giải
(a) Phương trình hoá học: 2Mg + O2 → 2MgO
Theo phương trình 2 1 2
(b) ${n_{MgO}} = \frac{8}{{40}} = 0,2{\text{ (mol)}} $
Theo phương trình: nMg = nMgO = 0,2 (mol)
MMg = 0,2.24 = 4,8 (gam)
(c) Cách 1: Theo phương trình: nO2 = ½nMgO = 0,1 (mol)
VO2 = 0,1.24,79 = 2,479 (lít)
Cách 2: Áp dung ĐLBT khối lượng: mO2 = mMgO – mMg = 8 – 4,8 = 3,2 (gam)
${n_{{O_2}}} = \frac{{3,2}}{{32}} = 0,1{\text{ (mol)}} $
VO2 = 0,1.24,79 = 2,479 (lít)
Câu 3: Đốt cháy hết 10 gam kim loại R (hóa trị II) bằng khí oxygen dư, thu được 14 gam oxide của kim loại R.
(a) Viết phương trình hóa học của phản ứng và tính khối lượng khí O2 phản ứng.
(b) Xác định nguyên tố kim loại R.
Hướng dẫn giải
(a) Phương trình hoá học: 2R + O2 → 2RO
Áp dụng ĐLBT khối lượng: mO2 = 14 – 10 = 4 (gam)
${n_{{O_2}}} = \frac{4}{{32}} = 0,125{\text{ (mol)}} $
(b) Theo phương trình: nR = 2nO2 = 2.0,125 = 0,25 (mol)
${{\text{M}}_R} = \frac{{10}}{{0,25}} = 40 $
Vậy nguyên tố R là Calcium (Ca)
Câu 4: Nung nóng potassium nitrate KNO3, chất này bị phân hủy tạo thành potassium nitrite KNO2 và O2. Tính khối lượng KNO3 cần dùng để điều chế được 2,4 gam O2. Biết hiệu suất phản ứng đạt 85%.
Hướng dẫn giải
Số mol O2 = 2,4 : 32 = 0,075 mol
2KNO3 $\xrightarrow{{{t^o}}} $ 2KNO2 + O2
2 ← 1 mol
0,15 ← 0,075 mol
Khối lượng KNO3 theo lý thuyết là: mlt = 0,15.101 = 15,15 gam.
Khối lượng KNO3 thực tế cần dùng là: ${m_{tt}} = \frac{{{m_{lt}}.100\% }}{{H\% }} = \frac{{15,15.100\% }}{{85\% }} = 17,8(gam) $
Câu 5: Thực hiện phản ứng ester hóa m gam CH3COOH bằng 1 lượng vừa đủ C2H5OH thu được 0,02 mol ester. Hiệu suất phản ứng H = 60%. Giá trị của m?
Hướng dẫn giải
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
1 mol → 1 mol
0,02 mol ← 0,02 mol
Theo lí thuyết: khối lượng CH3COOH cần dùng là: 60.0,02=1,2 g
Hiệu suất H% = 60% → thực tế khối lượng Acid đã dùng: $m = \frac{{1,2.100}}{{60}} = 2(gam) $
Vậy giá trị của m = 2 (gam)
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Cho phản ứng hóa học sau: $Al + {H_2}S{O_4}\xrightarrow{{}}A{l_2}{(S{O_4})_3} + {H_2}.$ Số mol H2SO4 phản ứng hết với 6 mol Al là
A. 6 mol. B. 9 mol. C. 3 mol. D. 5 mol.
Câu 2. Cho phản ứng hoá học sau: H2 + Cl2 → 2HCl. Số mol HCl được tạo ra khi có 0,1 mol H2 phản ứng với lượng dư Cl2 là
A. 0,1 mol. B. 0,2 mol. C. 0,3 mol. D. 0,4 mol.
Câu 3. Cho phản ứng hoá học: 2H2 + O2 → 2H2O. Số mol H2 đã tham gia phản ứng (biết khối lượng nước thu được sau phản ứng là 1,8 gam) là
A. 0,1 mol. B. 0,2 mol. C. 0,3 mol. D. 0,4 mol.
Câu 4. Mg phản ứng với HCl theo phản ứng: $Mg + HCl\xrightarrow{{}}MgC{l_2} + {H_2}.$ Sau phản ứng thu được 2.479 lít (đkc) khí hydrogen thì khối lượng của Mg đã tham gia phản ứng là
A. 2,4 gam. B. 12 gam. C. 2,3 gam. D. 7,2 gam.
Câu 5. Để tác dụng vừa đủ với 0,5 gam khí hydrogen thì cần dùng thể tích O2 (đkc) là
A. 1.549 lít. B. 3.099 lít. C. 5.312 lít. D. 6.198 lít.
Câu 6. Cho 12,8 gam một kim loại R hóa trị II tác dụng với khí chlorine vừa đủ, thu được 27 gam muối chloride (RCl2). R là kim loại
A. Fe. B. Ca. C. Cu. D. Mg.
Câu 7. Đốt cháy hoàn toàn 2,16 gam kim loại R (hóa trị III) trong khí oxygen thu được 4,08 gam một oxide của kim loại R duy nhất. Công thức hóa học của oxide là
A. Na. B. Ca. C. Al. D. Fe.
ĐÁP ÁN
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| B | B | A | A | B | C | C |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 8. Cho 13 gam zinc vào dung dịch chứa 16,425 gam HCl đến khi phản ứng hoàn toàn thu được zinc chloride (ZnCl2) và V lít khí H2 (đkc). Giá trị của V là
A. 4,958. B. 3,7185. C. 5,57775. D. 11,1555.
Câu 9. Đốt cháy 3,1 gam phosphorus trong lọ chứa 2.479 lít khí O2 (đkc) đến khi phản ứng hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 5,68. B. 7,10. C. 6,30. D. 4,97.
Câu 10. Trộn 10,8 g bột aluminum với bột sulfur dư. Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra thu được 25,5 g Al2S3. Tính hiệu suất phản ứng ?
A. 85% B. 80% C. 90% D. 92%
Câu 11. Một cơ sở sản xuất vôi tiến hành nung 4 tấn đá vôi (CaCO3) thì thu được 1,68 tấn vôi sống(CaO) và một lượng khí CO2. Tính hiệu suất của quá trình nung vôi.
A. 70% B. 75% C. 80% D. 85%
Câu 12. Cho 37.185 lít khí ethylen C2H4 (đkc) tác dụng với nước (dư) có Sulfuric acid làm xúc tác, thu được 13,8 gam C2H5OH. Tính hiệu suất phản ứng cộng nước của ethylen.
A. 20% B. 25% C. 30% D. 30,2%
ĐÁP ÁN
| 8 | 9 | 10 | 11 | 12 |
| A | C | A | B | A |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 13. Đốt cháy 6,0 gam hỗn hợp Y gồm các kim loại Al, Fe, Zn trong khí oxygen, sau một thời gian thu được 8,08 gam chất rắn Z gồm các oxide kim loại và kim loại còn dư. Thể tích khí oxygen đã phản ứng (đkc) là
A. 1,4874. B. 1,61135 C. 1,7353. D. 1,9832.
Hướng dẫn giải
Áp dụng ĐLBT khối lượng: mO2 = mZ – mY = 8,08 – 6,0 = 2,08 (gam)
${n_{{O_2}}} = \frac{{2,08}}{{32}} = 0,065{\text{ (mol)}} $
Vậy VO2 = 0,065.24,79 = 1,61135 (lít)
Chọn B
Câu 14. Ester CH3COOC2H5 (ethyl acetate) là một loại hoá chất được sử dụng rất nhiều trong nước hoa, trong các loại sơn móng tay. Hóa chất này rất phổ biến trong đời sống sinh hoạt hằng ngày và được điều chế theo sơ đồ sau:
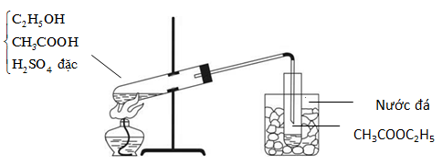
Đun nóng 6,0 gam CH3COOH với 6,0 gam C2H5OH (có H2SO4 làm xúc tác, hiệu suất phản ứng ester hoá bằng 50%). Khối lượng ester tạo thành là:
A. 6,0 gam B. 4,4 gam C. 8,8 gam D. 5,2 gam
Hướng dẫn giải
nCH3COOH = 0,1 (mol); nC2H5OH = 0,13 (mol)
Phương trình hoá học: CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Theo phương trình 1 1 1
Ta có $\frac{{0,1}}{1} < \frac{{0,13}}{1} $ nên CH3COOH phản ứng hết, C2H5OH còn dư → nCH3COOC2H5 (lí thuyết) = nCH3COOH = 0,1 (mol)
Vậy khối lượng ester thu được trên thực tế = 0,1.50%.88 = 4,4 (gam)
Chọn B
Câu 15. Đun 12 gam acetic acid với 1 lượng dư ethyl alcohol (có H2SO4 đặc làm xúc tác). Đến khi phản ứng dừng lại thu được 11 gam ester. Hiệu suất của phản ứng ester hoá là bao nhiêu?
A. 70% B. 75% C. 62,5% D. 50%
Hướng dẫn giải
nCH3COOH = 0,2 (mol); nCH3COOC2H5 = 0,125 (mol)
Phương trình hoá học: CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Theo phương trình 1 1 1
Ta có nCH3COOC2H5 (lí thuyết) = nCH3COOH = 0,2 (mol)
Vậy hiệu suất phản ứng $H\% = \frac{{0,125}}{{0,2}}.100\% = 62,5\% $
Chọn C









