- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 1 Sử Dụng Hóa Chất Dụng Cụ Và Các Thiết Bị Điện An Toàn
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 2 Biến Đổi Vật Lí Và Biến Đổi Hóa Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 3 Phản Ứng Hoá Học Và Năng Lượng Trong Các Phản Ứng
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 4 Định Luật Bảo Toàn Khối Lượng Và Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 5 Mol Và Tỉ Khối Của Chất Khí
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 6 Tính Theo Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 7 Nồng Độ Dung Dịch
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 8 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 9 Acid
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 10 Base
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 11 Thang pH
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 12 Oxide
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 13 Muối
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 14 Phân Bón Hóa Học
Chuyên đề KHTN 8 Chân trời sáng tạo bài 10 Base được soạn dưới dạng file word và PDF gồm 6 trang. Các bạn xem và tải về ở dưới.
BÀI 10: BASE
SGK CHÂN TRỜI SÁNG TẠO
A. TÓM TẮT LÝ THUYẾT
1. Khái niệm base
* Sodium hydroxide (NaOH): chất rắn, tan tốt trong nước và khi tan tỏa nhiều nhiệt.

– Base là hợp chất mà phân tử có một nguyên tử kim loại liên kết với một hay nhiều nhóm hydroxide (OH–). Ví dụ: NaOH, Mg(OH)2, Fe(OH)3,…
– Khi tan trong nước, phân tử base sẽ tạo ra ion OH–. Ví dụ:
$\begin{gathered}
{\text{NaOH }} & \to & {\text{N}}{{\text{a}}^{\text{ + }}} & + {\text{ }} & {\text{O}}{{\text{H}}^ – } \hfill \\
& {\text{(Ion sodium)}} & {\text{ }}({\text{Ion hydroxide)}} \hfill \\
\end{gathered} $
– Dựa vào tính tan trong nước, base được chia làm 2 loại:
+ Base tan tốt trong nước (kiềm): KOH, NaOH, Ba(OH)2,…
+ Base không tan trong nước: Mg(OH)2, Cu(OH)2,…
2. Tính chất hóa học của base
– Dung dịch base (kiềm) làm đổi màu chất chỉ thị:

Quỳ tím => Xanh |

Phenolphthalein => Hồng |
– Base tác dụng với một số acid tạo thành muối và nước:
$\begin{gathered}
{\text{NaOH }} & + & {\text{HCl}} & \to & {\text{NaCl}} & & + {\text{ }}{{\text{H}}_{\text{2}}}{\text{O}} \hfill \\
& & & {\text{ (Sodium chloride)}} \hfill \\
{\text{Mg(OH}}{{\text{)}}_{\text{2}}}{\text{ }} + & 2{\text{HCl}} & \to & {\text{MgC}}{{\text{l}}_{\text{2}}} & + {\text{ }} & 2{{\text{H}}_{\text{2}}}{\text{O}} \hfill \\
& & & {\text{ (Magnesium chloride)}} \hfill \\
\end{gathered} $
B. CÂU HỎI TRONG BÀI HỌC
Câu 1 [CTST trang 50]. Thành phần phân tử của các base có điểm gì chung?
Trả lời: Thành phần phân tử của các base đều có một nguyên tử kim loại liên kết với một hay nhiều nhóm hydroxide (OH–).
Câu 2 [CTST trang 50]. Hãy cho biết mối quan hệ giữa số nhóm OH và hóa trị của kim loại có trong phân tử base?
Trả lời: Số nhóm OH bằng với hóa trị của kim loại trong phân tử base.
Câu 3 [CTST trang 50]. Trường hợp nào base được gọi là kiềm?
Trả lời: Base tan tốt trong nước được gọi là kiềm. Ví dụ: KOH, NaOH, Ba(OH)2,…
Câu 4 [CTST trang 50]. Viết công thức chung của base chứa kim loại M hóa trị n.
Trả lời: Công thức chung của base chứa kim loại M hóa trị n là $\mathop {\text{M}}\limits^n {(\mathop {{\text{OH}}}\limits^{\text{I}} )_n}$
Câu 5 [CTST trang 51]. Màu của các base không tan là đặc trưng cho kim loại M (M) hay nhóm hydroxide (OH)?
Trả lời: Màu của các base không tan là đặc trưng cho kim loại M (M).
Câu 6 [CTST trang 51]. Sử dụng bảng tính tan ở phụ lục 1, hãy xác định các base sau đây tan hay không tan trong nước: NaOH, Fe(OH)3, Fe(OH)2, KOH.
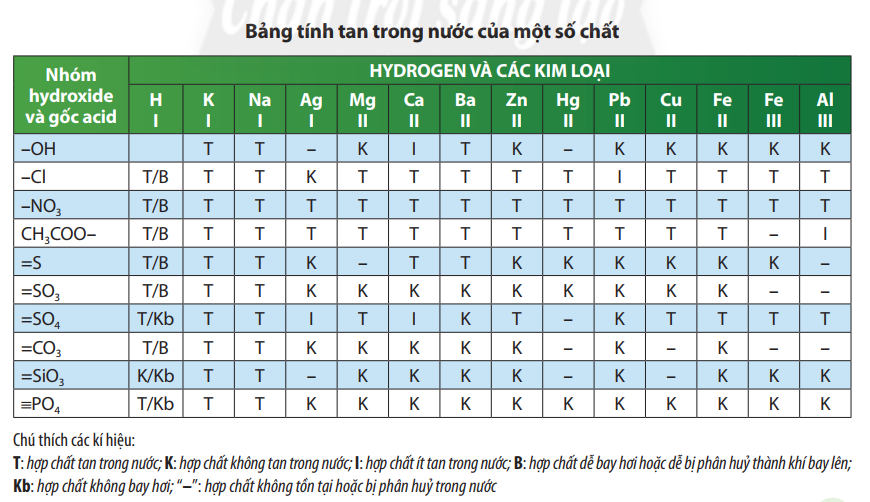
Trả lời: Các base tan trong nước: NaOH,KOH. Các base không tan trong nước: Fe(OH)3, Fe(OH)2.
Câu 7 [CTST trang 51]. Hãy nhận xét sự đổi màu của các chất chỉ thị ở Thí nghiệm 1 và 2.
Trả lời:
Thí nghiệm 1: Quỳ tím chuyển sang màu xanh.
Thí nghiệm 2: Dung dịch không màu chuyển sang màu hồng.
Câu 8 [CTST trang 51]. Nếu thay dung dịch NaOH bằng dung dịch KOH người ta cũng thấy chất chỉ thị đổi màu tương tự. Sự đổi màu chất chỉ thị là do ion nào gây nên?
Trả lời: Sự đổi màu các chất chỉ thị là do ion OH– gây nên.
Câu 9 [CTST trang 52]. Bằng cách đơn giản nào ta có thể nhận biết dung dịch có tính base?
Trả lời: Dùng quỳ tím (quỳ tím chuyển sang màu xanh) hoặc dung dịch phenolphthalein (dung dịch không màu chuyển sang màu hồng).
Câu 10 [CTST trang 52]. Nêu hiện tượng xảy ra sau khi cho dung dịch HCl vào ở Thí nghiệm 3. Giải thích.
Trả lời:
Hiện tượng: Trước phản ứng dung dịch có màu hồng; Sau phản ứng dung dịch không màu.
Giải thích:
+ Trước phản ứng dung dịch có màu hồng do NaOH có môi trường base làm hồng phenolphthalein.
+ Sau phản ứng thu được muối NaCl có môi trường trung tính không làm đổi màu phenolphthalein.
$NaOH + HCl \to NaCl + {H_2}O$
(Hồng) (Không màu)
Câu 11 [CTST trang 52]. Nêu hiện tượng và viết phương trình hóa học khi cho từ từ dung dịch H2SO4 loãng vào dung dịch KOH (có nhỏ 1-2 giọt phenolphthalein).
Trả lời:
Hiện tượng: Trước phản ứng dung dịch có màu hồng; Sau phản ứng dung dịch không màu.
Phương trình hoá học:
$2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O$
(Hồng) (Không màu)
Câu 12 [CTST trang 52]. Người ta thường dùng hóa chất có tính acid để tẩy rửa máy móc thiết bị đã dính dầu mỡ, nên nước thải thường có tính acid cá. Nếu không làm sạch nước thải thì dễ gây hại cho môi trường. Theo em, với nước thải công nghiệm nói trên, người ta thường dùng hóa chất gì để xử lí?
Trả lời:Với nước thải công nghiệp nói trên người ta dùng dung dịch kiềm để xử lí. Dung dịch kiềm hay được sử dụng là nước vôi trong (Ca(OH)2).
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. TỰ LUẬN
Câu 1: Hãy cho biết các base sau: NaOH, KOH, Ba(OH)2, Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3. tan hay không tan trong nước?
Trả lời:
– Base tan trong nước: NaOH, KOH, Ba(OH)2
– Base không tan trong nước: Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3
Câu 2: Để tránh nguyên liệu bị vụn khi chế biến trong quá trình làm mứt người ta thường ngâm nguyên liệu với nước vôi trong.Trong quá trình đó, độ chua của một số loại quả giảm đi. Vì sao lại như vậy?
Trả lời:
Vì nước vôi trong có tính kiềm nên xảy ra phản ứng trung hòa với acid trong một số loại quả làm giảm độ chua.
Câu 3: Tục lệ ăn trầu đã trở thành nét văn hóa truyền thống của người Việt Nam. Khi ăn trầu người ta thường quệt vôi tôi (Ca(OH)2)vào trầu, những người ăn trầu thường có hàm răng rất chắc và bóng. Giải thích tại sao? Biết lớp men răng cứng, dày khoảng 2mm là hợp chất Ca5(PO4)3OH.
Trả lời:
Răng được bảo vệ bởi lớp men cứng, dày khoảng 2mm. Lớp men này là hợp chất Ca5(PO4)3OH và được tạo thành theo phản ứng:
5Ca2+ + 3PO43- + OH¯ $\overset {} \leftrightarrows $Ca5(PO4)3OH
Khi ăn trầu quệt thêm vôi tôi, một lượng nhỏ Ca2+ và OH¯ được bổ sung vào quá trình để hình thành men răng. Do đó những người ăn trầu thường có hàm răng rất chắc và bóng.
Câu 4: Trong nước thải của nhà máy hóa chất có lẫn một số muối của kim loại nặng như: Cu(NO3)2, Fe(NO3)3. Hãy nêu biện pháp hóa học để xử lý nước thải ra môi trường.
Trả lời:
Dùng nước vôi để kết tủa hết các ion kim loại dưới dạng hydroxide.
Câu 5: Giải thích vì sao người ta thường quét vôi xung quanh gốc cây?
Trả lời:
Vì vôi có tác dụng cải tạo và ngăn chặn sự suy thoái của đất, hạn chế bào tử nấm phát triển trên cây trồng. Trong trồng trọt, biện pháp này được áp dụng khá phổ biến với cây thân gỗ, cây ăn trái và cây công nghiệp nhằm chống lại sự tấn công của nấm bệnh hay sâu bọ gây hại như sâu đục thân tìm đến đẻ trứng vào những kẽ nứt.
Để quét vôi trắng vào gốc cây không chỉ là nước vôi thuần túy mà phải là loại vôi có chứa lưu huỳnh… theo tỷ lệ nhất định nhằm làm mát cho cây vào ngày nắng nóng, vừa phản xạ với ánh sáng vừa làm giảm sự bay hơi nước ở cây.
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Sodium hydroxide (hay xút ăn da) là chất rắn, không màu, dễ nóng chảy, hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Công thức của sodium hydroxide
A. Ca(OH)2. B. NaOH. C. NaHCO3. D. Na2CO3.
Câu 2: Base làm đổi màu giấy quỳ tím sang màu nào?
A. Xanh. B. Đỏ. C. Tím D. Vàng
Câu 3: Base không tan trong nước là
A. Cu(OH)2 B. NaOH C. KOH D. Ca(OH)2
Câu 4: Cho vài giọt dung dịch phenolphthalein không màu vào dung dịch NaOH. Hiện tượng xảy ra là
A. dung dịch không màu. B. dung dịch chuyển màu xanh.
C. xuất hiện kết tủa trắng. D. dung dịch chuyển màu hồng.
Câu 5. Chất nào sau đây là base?
A. NaOH. B. NaNO3. C. NaCl. D. Na2SO4.
Câu 6: Thành phần phân tử của base gồm
A. một nguyên tử kim loại và một hay nhiều nhóm –OH.
B. một nguyên tử kim loại và nhiều nhóm –OH.
C. một hay nhiều nguyên tử kim loại và một hay nhiều nhóm –OH.
D. một hay nhiều nguyên tử kim loại và nhiều nhóm –OH.
Câu 7: Trong các chất sau: KCl, AgCl, Ca(OH)2, CuSO4, Ba(OH)2, KHCO3. Số chất trong dãy thuộc loại base là
A. 1 B. 3. C. 4. .D. 2.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| B | A | A | D | A | A |
D |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 8: Cho các chất sau: NaCl, HCl, H2SO4, Ba(OH)2, Ca(OH)2, Mg(OH)2, K2CO3, AlCl3, NaOH. Số các chất có khả năng làm quỳ ẩm chuyển xanh là
A. 2. B. 3. C. 4. D. 5.
Hướng dẫn:
Các chất có khả năng làm quỳ ẩm chuyển xanh là các base tan: Ba(OH)2, Ca(OH)2, NaOH.
Câu 9: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, thêm từ từ dung dịch HCl cho đến dư vào dung dịch có màu xanh trên thì
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn.
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ.
D. Màu xanh đậm thêm dần
Hướng dẫn:
Dung dịch HCl xảy ra trung hòa với dung dịch KOH làm cho màu xanh nhạt dần rồi mất màu. Khi HCl thêm vào đến dư thì acid làm quỳ tím chuyển sang màu đỏ.
Câu 10: Dãy chất nào dưới đây là dung dịch kiềm?
A. KOH, Mg(OH)2, Ba(OH)2, NaOH.
B. KOH, Ca(OH)2, Ba(OH)2, NaOH.
C. KOH, Mg(OH)2, Ba(OH)2, Fe(OH)2.
D. Cu(OH)2, Mg(OH)2, Ba(OH)2, NaOH.
Câu 11: Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hóa xanh.
B. Làm quỳ tím hóa hồng.
C. Tác dụng với acid tạo thành muối và nước.
D. Làm dung dịch phenolphthalein hóa hồng.
Câu 12: Vôi sống khi cho tác dụng với nước nó trở thành vôi tôi (Ca(OH)2), được sử dụng trong các loại vữa để làm tăng độ lên kết và độ cứng. Vôi sống cũng được sử dụng trong sản xuất thủy tinh, kim loại/hợp kim để loại bỏ các tạp chất dưới dạng xỉ. Trong nông nghiệp, vôi sống không chỉ đơn thuần là phân bón cung cấp dưỡng chất calcium cho cây trồng mà còn ngăn chặn sự suy thoái của đất, ức chế sự phát triển của nấm bệnh trong đất, phát huy hiệu lực của phân bón và thuốc diệt cỏ….Khi sản xuất vôi sống phải được bảo quản trong bao kín nếu không để lâu ngày vôi sẽ hóa đá. Phản ứng nào sau đây giải thích hiện tượng vôi sống hóa đá?
A. Ca(OH)2 + CO2 → CaCO3 + H2O
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
C. CaO + CO2 → CaCO3
D. CaO + H2O → Ca(OH)2
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| B | C | B | B |
C |
MỨC ĐỘ 3: VẬN DỤNG (3 câu)
Câu 13: Cho 100 ml dung dịch Ba(OH)2 0,1M vào 100 ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng
A. Làm quỳ tím hoá xanh.
B. Làm quỳ tím hoá đỏ.
C. Làm mất màu giấy quỳ tím.
D. Không làm đổi màu quỳ tím.
Hướng dẫn:
${{\text{n}}_{{\text{Ba(OH}}{{\text{)}}_{\text{2}}}}}{\text{ = 0,1}}{\text{.0,1 = 0,01 mol}}$
${{\text{n}}_{{\text{HCl}}}}{\text{ = 0,1}}{\text{.0,1 = 0,01 mol}}$
$\begin{gathered}
Ba{(OH)_2} + 2HCl \to BaC{l_2} + 2{H_2}O \hfill \\
\,\,\,\,\,\,0,01\,\,\,\,\,\,\,\,\,\,\,\,\,0,01\,\,\,\,\,mol \hfill \\
\end{gathered} $
Ta có: $\frac{{{n_{Ba{{(OH)}_2}}}}}{1} > \frac{{{n_{HCl}}}}{2}$
→ Ba(OH)2 dư, dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh.
Chọn A
Câu 14: Nếu bị bỏng do vôi bột thì người ta sẽ chọn phương án nào sau đây là tối ưu để sơ cứu?
A. Rửa sạch vôi bột bằng nước rồi rửa lại bằng dung dịch NH4Cl 10%.
B. Lau khô sạch bột rồi rửa bằng dung dịch NH4Cl 10%.
C. Chỉ rửa sạch vôi bột bằng nước rồi lau khô.
D. Lau khô sạch bột rồi rửa bằng nước xà phòng loãng.
Hướng dẫn:
Vôi bột khi gặp nước sẽ phản ứng toả nhiệt làm cho bỏng càng nặng hơn:
CaO + H2O $ \to $ Ca(OH)2 + Q.
Vì vậy cần phải lau khô bột trước đã rồi dùng một dung dịch có tính axit trung hoà với Ca(OH)2.
Chọn B
 Câu 15: Ong đốt, hoặc kiến đốt gây cảm giác ngứa hoặc đau nhức, trong thành phần nước bọt của côn trùng trên có chứa acid formic (HCOOH). Để giảm đau nhức do vết đốt nên dùng chất nào sau đây?
Câu 15: Ong đốt, hoặc kiến đốt gây cảm giác ngứa hoặc đau nhức, trong thành phần nước bọt của côn trùng trên có chứa acid formic (HCOOH). Để giảm đau nhức do vết đốt nên dùng chất nào sau đây?
A. Muối ăn. B. Giấm ăn. C. Cồn iot. D. Vôi tôi.
Hướng dẫn:
Khi bôi vôi tôi (Ca(OH)2) vào vết đốt sẽ có tác dụng giảm đau do xảy ra phản ứng trung hòa acid và base.
Chọn D








