- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 1 Sử Dụng Hóa Chất Dụng Cụ Và Các Thiết Bị Điện An Toàn
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 2 Biến Đổi Vật Lí Và Biến Đổi Hóa Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 3 Phản Ứng Hoá Học Và Năng Lượng Trong Các Phản Ứng
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 4 Định Luật Bảo Toàn Khối Lượng Và Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 5 Mol Và Tỉ Khối Của Chất Khí
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 6 Tính Theo Phương Trình Hoá Học
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 7 Nồng Độ Dung Dịch
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 8 Tốc Độ Phản Ứng Và Chất Xúc Tác
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 9 Acid
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 10 Base
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 11 Thang pH
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 12 Oxide
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 13 Muối
- Chuyên Đề KHTN 8 Chân Trời Sáng Tạo Bài 14 Phân Bón Hóa Học
Chuyên đề KHTN 8 Chân trời sáng tạo bài 8 Tốc độ phản ứng và chất xúc tác được soạn dưới dạng file word và PDF gồm 10 trang. Các bạn xem và tải về ở dưới.
BÀI 8: TỐC ĐỘ PHẢN ỨNG VÀ CHẤT XÚC TÁC
A. TÓM TẮT LÝ THUYẾT:
1. Tốc độ phản ứng:
– Là đại lượng đánh giá mức độ nhanh hay chậm của một phản ứng hóa học.
2. Các yếu tố ảnh hưởng đến tốc độ phản ứng:
– Các yếu tố chính ảnh hưởng đến tốc độ của 1 phản ứng hóa học: Nồng độ các chất phản ứng, nhiệt độ của phản ứng, diện tích tiếp xúc, và chất xúc tác.
– Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về chất và lượng sau khi phản ứng.




3. Ứng dụng thực tiễn của tốc độ phản ứng:



B. CÂU HỎI TRONG BÀI HỌC
Câu 1. [CTST – SGK] Quan sát hình 8.1 SGK em hãy cho biết hiện tượng nào xảy ra nhanh, hiện tượng nào xảy ra chậm?

Hướng dẫn giải:
– Hiện tượng đốt cháy que diêm xảy ra nhanh
– Hiện tượng bu lông bị gỉ sét xảy ra chậm.
Câu 2. [CTST – SGK] Theo em, các phản ứng hóa học khác nhau thì thời gian phản ứng có giống nhau không.
Hướng dẫn giải:
Các phản ứng hóa học khác nhau thì thời gian phản ứng khác nhau.
Câu 3. [CTST – SGK] Ống nghiệm nào có hiện tượng sủi bọt khí nhanh hơn? Giải thích?

Hướng dẫn giải:
– Ống nghiệm ở hình (b) có hiện tượng sủi bọt khí nhanh hơn. Vì nồng độ H2SO4 ở hình (b) là 2M lớn hơn nồng độ H2SO4 ở hình (a) 0,1M
Câu 4. [CTST – SGK] Vì sao nồng độ chất phản ứng càng lớn thì tốc độ phản ứng càng tăng.
Hướng dẫn giải:
– Khi tăng nồng độ chất phản ứng thì số va chạm hiệu quả tăng lên nên tốc độ phản ứng tăng.
Câu 5. [CTST – SGK] Tốc độ thoát khí ở hai ống nghiệm giống nhau không? Giải thích?

Hướng dẫn giải:
Tốc độ thoát khí ở hai ống nghiệm là khác nhau. Cụ thể ống nghiệm (1) được đun nóng khí thoát ra nhanh và mạnh hơn, do tốc độ phản ứng lớn hơn.
Câu 6. [CTST – SGK] Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Hướng dẫn giải:
Nhiệt độ tăng sẽ làm cho các nguyên tử hay phân tử chất chuyển động nhanh hơn, gia tăng sự va chạm, tốc độ phản ứng tăng.
Câu 7. [CTST – SGK] Ống nghiệm nào có lượng khí thoát ra nhanh hơn? Giải thích?

Hướng dẫn giải:
– Ống nghiệm (2) khí thoát ra nhanh và mạnh hơn, do tốc độ phản ứng lớn hơn.
Câu 8. [CTST – SGK] Diện tích tiếp xúc của 1 chất có ảnh hưởng như thế nào đến tốc độ phản ứng?
Hướng dẫn giải:
– Tốc độ phản ứng sẽ tăng lên nếu tăng diện tích bề mặt của chất tham gia bằng cách nghiền nhỏ, đập phẳng hoặc cắt thành nhiều mảnh.
Câu 9. [CTST – SGK] Ống nghiệm nào sinh ra khí oxygen sớm hơn để làm que đóm bùng cháy trở lại?

Hướng dẫn giải:
– Ống nghiệm (2) sinh ra khí oxygen sớm hơn để làm que đóm bùng cháy trở lại.
Câu 10. [CTST – SGK] Ống nghiệm (2) có thêm 1 ít bột MnO2, chất này có tác dụng gì đến tốc độ phản ứng so với ống nghiệm (1) không có MnO2?
Hướng dẫn giải:
– MnO2 là chất xúc tác, có tác dụng làm cho phản ứng diễn ra nhanh hơn (tăng tốc độ phản ứng) so với không dùng chất xúc tác.
Câu 11. [CTST – SGK] Quan sát hình 8.6, các yếu tố nào ảnh hưởng đến tốc độ phản ứng được sử dụng trong đời sống thực tiễn.

Hướng dẫn giải:
a) Chẻ nhỏ củi để nhóm lửa dễ hơn: yếu tố diện tích tiếp xúc để diện tích tiếp xúc tăng lên tốc độ cháy nhanh hơn.
b) Bảo quản thực phẩm bằng tủ lạnh: yếu tố nhiệt độ thấp để làm chậm quá trình hư hỏng của thực phẩm.
c) Dùng quạt để nhóm lửa: yếu tố nồng độ.
C. CÂU HỎI CUỐI BÀI HỌC
Câu hỏi. [CTST – SGK] Các quả pháo hoa khi được bắn lên sẽ bốc cháy nhanh và nổ ra thành những chùm ánh sáng đẹp mắt. Vì sao khi sản xuất pháo hoa người ta thường sử dụng các nguyên liệu ở dạng bột?
Hướng dẫn giải:
Khi sản xuất pháo hoa người ta thường sử dụng các nguyên liệu ở dạng bột để tăng diện tích tiếp xúc giữa các chất phản ứng, giúp phản ứng diễn ra nhanh hơn.
D. TỰ LUẬN
Câu 1. Một nhóm học sinh thực hiện hai thí nghiệm sau:
– Thí nghiệm 1: Cho zinc viên vào 25 mL dung dịch hydrochloric acid 0,5 M.
– Thí nghiệm 2: Cho zinc bột vào 25 mL dung dịch hydrochloric acid 0,5 M.
Biết khối lượng Zn được lấy ở hai thí nghiệm là bằng nhau và lượng dung dịch HCl được lấy dư so với lượng cần thiết.
a. Viết phương trình phản ứng hóa học xảy ra trong các thí nghiệm trên.
b. So sánh tốc độ phản ứng giữa thí nghiệm 1 và thí nghiệm 2, giải thích.
Hướng dẫn giải:
a. Zn + 2HCl $ \to $ ZnCl2 + H2
b. Tốc độ thí nghiệm (2) phản ứng xảy ra với tốc độ nhanh hơn so với tốc độ phản ứng của thí nghiệm 1 vì zinc lấy ở dạng bột làm tăng diện tích tiếp xúc bề mặt => Tốc độ phản ứng tăng.
Câu 2. Năm 1785, một vụ nổ xảy ra tại nhà kho chuyên làm bột mì tại Giacomelli (Roma, Italia). Nguyên nhân được xác định là do bột mì bay trong không khí, chạm tới nguồn lửa của chiếc đèn, dẫn tới đám cháy và đây là vụ nổ bụi đầu tiên trong lịch sử. Sau đó là các vụ nổ bụi trong hầm than, xưởng sản xuất sữa bột, dược phẩm, nhựa, kim loại, … có tác nhân tương tự gồm: nguồn oxygen, nhựa, nguồn nhiệt có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín.

Hình 6.18.a. Nguyên nhân cháy gây ra bởi bụi bột mì
Thí nghiệm như hình dưới đây cho thấy, bột mì không dễ cháy. Tại sao bột mì và một số loại bụi khác có thể gây ra nổ bụi? Để ngăn ngừa và hạn chế nổ bụi có thể can thiệp vào những tác nhân nào?

Hình 6.18.b. Thí nghiệm đốt cháy bột mì.
Hướng dẫn giải:
Bột mì trên bát hay tập trung thành dạng cục thì thì rất khó cháy, nếu được phân bố ở dạng bụi sẽ dễ cháy hơn do tăng diện tích tiếp xúc bề mặt lên gấp nhiều lần. Khi đạt đủ 5 tác nhân: nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín sẽ gây ra vụ nổ thứ cấp (nổ dây chuyền). Để ngăn ngừa và hạn chế nổ bụi có thể can thiệp vào hai yếu tố chính: giảm nồng độ hạt bụi và kiểm soát nguồn nhiệt trong khu vực sản xuất (hệ thống điện, nguồn điện, ổ cắm, …).

Câu 3. Khí nitrogen và oxygen có thể cùng tồn tại trong cùng một bình kín ở điều kiện bình thường mà không nguy hiểm. Nhưng dưới tác dụng của tia lửa điện hoặc một ít bột kim loại được thêm vào thì có phản ứng hoá học xảy ra và khí tạo thành rất độc.
a. Tia lửa điện có phải chất xúc tác không? Giải thích?
b. Bột kim loại có phải chất xúc tác không? Giải thích?
Hướng dẫn giải:
a. Tia lửa điện không phải là chất xúc tác, nó chỉ cung cấp năng lượng. Các phân tử nitrogen và oxygen hấp thụ năng lượng đó để có năng lượng cao hơn giá trị năng lượng hoạt hoá để phản ứng xảy ra.
b. Bột kim loại là chất xúc tác có tác dụng làm giảm năng lượng hoạt hoá làm phản ứng hoá học xảy ra nhanh hơn.
Câu 4.
a. Vì sao người ta tạo ra những lỗ hổng trong các viên than tổ ong?
b. Giải thích vì sao khi nhóm lò than người ta phải quạt gió vào lò bằng quạt tay hoặc quạt máy? Còn khi ủ than người ta lại đậy nắp lò than?
Hướng dẫn giải:
a. Trong những viên than tổ ong người ta tạo ra những lỗ hổng do vận dụng yếu tố ảnh hưởng của diện tích tiếp xúc bề mặt đến tốc độ phản ứng. Khi đục nhiều lỗ nhỏ ở viên than làm tăng diện tích tiếp xúc bề mặt giữa than và không khí làm tăng tốc độ phản ứng.
b. Khi nhóm lò than người ta phải quạt gió vào lò bằng quạt tay hoặc quạt máy với mục đích làm tăng lượng oxi trong không khí để quá trình cháy diễn ra dễ dàng hơn => Vận dụng ảnh hưởng cả yếu tố nồng độ tới tốc độ phản ứng.
Khi ủ bếp than người ta đậy nắp lò than là do vận dụng ảnh hưởng của nồng độ đến tốc độ phản ứng nhằm mục đích giảm nồng độ O2 để hạn chế quá trình cháy.
Câu 5. Cho biết tốc độ phản ứng thay đổi như thế nào trong từng trường hợp sau? Giải thích
 |
 |
| Hình 6.8.a. Khi nấu thức ăn chúng ta thường hay cắt thức ăn thành các miếng nhỏ hơn | Hình 6.8.b. Khi giặt quần áo chúng ta thường cho nhiều bột giặt vào chỗ vết bẩn |
Hướng dẫn giải:
a. Khi nấu thức ăn thường hay cắt nhỏ thức ăn bởi vì làm tăng diện tích tiếp xúc bề mặt làm thức ăn nhanh chín hơn.
b. Khi giặt quần áo thường cho nhiều bột giặt vào chỗ vết bẩn vì khi tăng nồng độ của bột giặt làm tốc độ phản ứng tăng dẫn tới vết bẩn nhanh sạch.
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1: Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hoá học người ta dùng đại lượng nào dưới đây?
A. Nhiệt độ. B. Tốc độ phản ứng.
C. Áp suất. D. Thể tích khí.
Câu 2: Chất làm tăng tốc độ phản ứng hoá học mà không bị biến đổi chất được gọi là
A. Chất xúc tác. B. Chất trung gian.
C. Chất sản phẩm. D. Chất tham gia.
Câu 3: Một phản ứng hoá học được biểu diễn như sau: Các chất phản ứng → Các sản phẩm. Yếu tố nào sau đây không ảnh hướng đến tốc độ phản ứng?
A. Chất xúc tác. B. Nồng độ các chất phản ứng.
C. Nồng độ các sản phẩm. D. Nhiệt độ
Câu 4: Cho phản ứng hoá học: A(g) + B(g) → C(g) + D(g). Yếu tố nào không ảnh hưởng đến tốc độ phản ứng?
A. Nhiệt độ. B. Nồng độ chất C và chất D.
C. Chất xúc tác. D. Áp suất.
Câu 5: Trong các phản ứng sau, phản ứng nào xảy ra với tốc độ nhanh nhất?
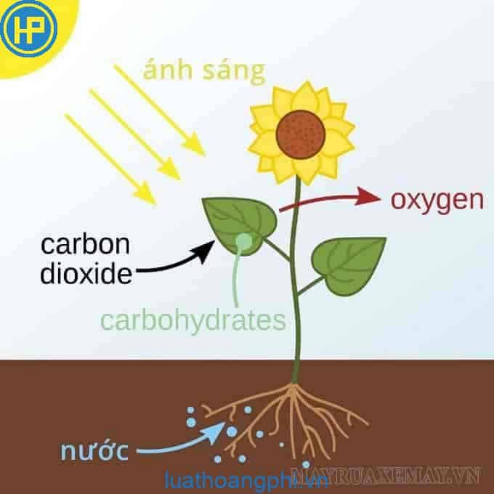 |
 |
| A. Quá trình quang hợp | B. Quá trình gỉ của sắt. |
 |
 |
| C. Quá trình đốt cháy magnesium
trong oxygen. |
D. Quá trình lên men rượu. |
Câu 6: Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ. B. Chất xúc tác. C. Nồng độ. D. Áp suất.
Câu 7: Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng zinc với dung dịch hydrochloric acid
– Nhóm thứ nhất: Cân 1 gam zinc miếng và thả vào cốc đựng 200 ml dung dịch acid HCl 2M.
– Nhóm thứ hai: Cân 1 gam zinc bột và thả vào cốc đựng 300 ml dung dịch acid HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
A. Nhóm thứ hai dùng acid nhiều hơn.
B. Diện tích bề mặt zinc bột lớn hơn zinc miếng.
C. Nồng độ zinc bột lớn hơn.
D. Cả ba nguyên nhân đều sai.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| B | A | C | B | C | B |
B |
MỨC ĐỘ 2: HIỂU (5 câu)
Câu 8: Các enzyme là chất xúc tác, có chức năng
A. Giảm năng lượng hoạt hoá của phản ứng.
B. Tăng năng lượng hoạt hoá của phản ứng.
C. Tăng nhiệt độ của phản ứng.
D. Giảm nhiệt độ của phản ứng.
Câu 9: Dưới đây là một số hiện tượng xảy ra trong đời sống, hãy sắp xếp theo thứ tự tốc độ phản ứng giảm dần:
(1) Phản ứng cháy của xăng, dầu.
(2) Các thanh thép ở các công trường xây dựng bị oxi hoá bởi các tác nhân trong không khí.
(3) Phản ứng lên men rượu từ trái cây.
(4) Nướng bánh mì.
A. (1) > (4) > (3) > (2). B. (1) > (4) > (2) > (3).
C. (4) > (1) > (2) > (3). D. (1) > (3) > (4) > (2).
Câu 10: Ở cùng một nồng độ, phản ứng nào dưới đây có tốc độ phản ứng xảy ra chậm nhất:
A. Al + dd NaOH ở 25 ℃. B. Al + dd NaOH ở 30 ℃.
C. Al + dd NaOH ở 40 ℃. D. Al + dd NaOH ở 50 ℃.
Câu 11: Khi cho cùng một lượng magnesium vào cốc đựng dung dịch acid HCl, tốc độ phản ứng sẽ lớn nhất khi dùng magnesium ở dạng
A. Viên nhỏ. B. Bột mịn, khuấy đều.
C. Lá mỏng. D. Thỏi lớn.
Câu 12: Lấy một chai nước ngọt có ga rót vào cốc thật nhẹ tay, sau đo từ từ cho đường cát trắng vào trong cốc. Hiện tượng xảy ra là
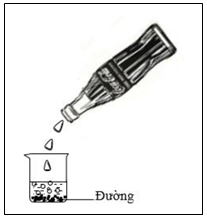
Hình 6.31. Rót nước ngọt có gas vào cốc có đường
A. Nước ngọt sủi bọt li ti. B. Nước ngọt sủi bọt rất nhiều và mạnh.
C. Nước ngọt mất bọt khí. D. Xuất hiện kết tủa đen.
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| A | A | A | B |
B |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 13: Phản ứng phân huỷ hydrogen peroxide có xúc tác được biểu diễn:
2 H2O2 $\xrightarrow{{Mn{O_2},\,{t^0}}}$2H2O + O2
Yếu tố không ảnh hưởng đến tốc độ phản ứng là
A. Nồng độ H2O2. B. Nồng độ của H2O.
C. Nhiệt độ. D. Chất xúc tác MnO2.
Câu 14: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang) theo sơ đồ sau:
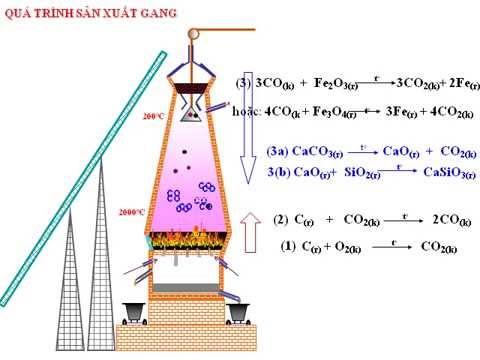
Hình 6.32. Sơ đồ sản xuất gang
Từ thế kỉ XIX, người ta nhận thấy rằng trong thành phần của khí lò cao (lò luyện gang) còn chứa khí CO. Nguyên nhân của hiện tượng này là
A. Lò xây chưa đủ độ cao.
B. Thời gian tiếp xúc của CO và Fe3O3 chưa đủ.
C. Nhiệt độ chưa đủ cao.
D. Phản ứng giữa CO và iron oxide là thuận nghịch.
Câu 15: Trong các cặp phản ứng sau, cặp nào có tốc độ phản ứng lớn nhất? (Giả sử các phản ứng đều dùng 100ml dung dịch)
A. Fe + dd HCl 0,1 M. B. Fe + dd HCl 0,2 M.
C. Fe + dd HCl 20%, (d = 1,2 g/mL). D. Fe + dd HCl 0,3 M.
ĐÁP ÁN
| 13 | 14 | 15 |
| B | B | C |
Hướng dẫn giải:
Câu 15:
${n_{HCL}} = \frac{{100.1,2.20}}{{100.35,5}} = 0,675 \to \left[ {HCl} \right] = 6,76$
Trong dd HCl 20%








