- Đề Thi Giữa Học Kỳ 2 Hóa 10 Năm 2022-2023 Có Đáp Án-Đề 1
- Đề Thi Giữa Học Kỳ 2 Hóa 10 Chân Trời Sáng Tạo Có Đáp Án-Đề 2
- Bộ Đề Ôn Tập Giữa Học Kỳ 2 Hóa 10 Chân Trời Sáng Tạo Năm 2022-2023
- Đề Kiểm Tra Giữa Học Kỳ 2 Hóa 10 Sở GD Bắc Ninh 2022-2023 Có Đáp Án
- Đề Cương Ôn Tập Giữa HK2 Hóa 10 Chân Trời Sáng Tạo 2022-2023
- Đề Cương Ôn Tập Hóa 10 Giữa HK2 Năm Học 2022-2023
- Đề Thi Giữa HK2 Hóa 10 Chân Trời Sáng Tạo Cấu Trúc Mới Giải Chi Tiết-Đề 1
- Đề Thi Giữa Học Kỳ 2 Hóa 10 CTST Cấu Trúc Mới Giải Chi Tiết-Đề 2
- Đề Thi Giữa HK2 Hóa 10 Kết Nối Tri Thức Cấu Trúc Mới Giải Chi Tiết
- Đề Kiểm Tra Giữa Học Kỳ 2 Hóa 10 Kết Nối Tri Thức Cấu Trúc Mới Giải Chi Tiết-Đề 2
- Đề Thi Giữa Học Kỳ 1 Hóa 10 Cánh Diều Cấu Trúc Mới Giải Chi Tiết
- Đề Cương Ôn Giữa HK2 Hóa 10 Chân Trời Sáng Tạo 2023-2024 Theo Từng Bài Học
- Đề Thi Giữa Kỳ 2 Hóa 10 Kết Nối Tri Thức 2023-2024 Có Ma Trận Đặc Tả
Đề thi giữa HK2 Hóa 10 Chân trời sáng tạo cấu trúc mới giải chi tiết-Đề 1 được soạn dưới dạng file word và PDF gồm 5 trang. Các bạn xem và tải về ở dưới.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Mô tả nào sau đây là đúng theo phương trình nhiệt hóa học sau :
${N_2}\left( {\;g} \right) + {O_2}\left( {\;g} \right) \to NO\left( g \right)\;\,\,\,\,\,{\Delta _r} = + 179,20\;kJ$
A. Ở điều kiện chuẩn, phản ứng của $\;\frac{1}{2}\,mol\;{N_2}\left( {\;g} \right)$ với $\;\frac{1}{2}mo{l_2}\left( {\;g} \right)$ thu được $1\;molNO\left( g \right)$ và giải phóng lượng nhiệt 179,2 KJ.
B. Ở điều kiện chuẩn, phản ứng của $\;\frac{1}{2}\;mol\;{N_2}\left( {\;g} \right)$ với $\;\frac{1}{2}\;mol{O_2}\left( {\;g} \right)$ thu được $1\;molNO\left( g \right)$ và giải phóng lượng nhiệt 358,4 KJ.
C. Ở điều kiện chuẩn, phản ứng của $\;\frac{1}{2}\;mol\;{N_2}\left( {\;g} \right)$ với $\;\frac{1}{2}\;mol{O_2}\left( {\;g} \right)$ thu được $1\;molNO\left( g \right)$ và hấp thu một lượng nhiệt là 179,20 kJ, ta nói enthalpy tạo thành chuẩn của $NO\left( g \right)$ là $ + 179,20\;kJ/mol$.
D. Ở điều kiện chuẩn, phản ứng của $1\;mol\;{N_2}\left( {\;g} \right)$ với $1\;mo{l_2}\left( {\;g} \right)$ thu được $2\;molNO\left( g \right)$ và hấp thu một lượng nhiệt là $179,20\;kJ$, ta nói enthalpy tạo thành chuẩn của NO (g) là $ + 179,20\;kJ/mol$.
Câu 2. Cho phương trình nhiệt hoá học của phản ứng.
$2{H_2}\left( g \right) + {O_2}\left( g \right) \to 2{H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\Delta _r} = – 571,68\;kJ$
Phản ứng trên là phản ứng
A. không có sự thay đổi năng lượng.
B. toả nhiệt và giải phóng $571,68\;kJ$ nhiệt.
C. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
D. thu nhiệt và hấp thu 571,68 kJ nhiệt.
Câu 3. Chất nào sau đây có nhiệt tạo thành chuẩn bằng 0 ?
A. $N{a_2}O\left( s \right)$. B. ${O_2}\left( {\;g} \right)$. C. ${H_2}O\left( I \right)$ D. $C{O_2}\left( {\;g} \right)$.
Câu 4. Phát biểu nào sau đây sai?
A. Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào càng ít.
B. Một phản ứng có giá trị biến thiên enthalpy lớn hơn 0 thì phản ứng đó là phản ứng thu nhiệt.
C. Một phản ứng có giá trị biến thiên enthalpy nhỏ hơn 0 thì phản ứng đó là phản ứng tỏa nhiệt.
D. Đơn vị của ${\Delta _r}H$ hay ${\Delta _r}H_{298}^0$ đều có thể là kJ, kcal,…
Câu 5. Chất khử còn gọi là
A. chất nhận electron. B. chất nhường proton.
C. chất giảm số oxi hoá. D. chất bị oxi hoá.
Câu 6. Cho phương trình nhiệt hoá học của phản ứng tạo thành $NO\left( g \right)$ trong không khí như sau:
${N_2}\left( g \right) + {O_2}\left( g \right) \to 2NO\left( g \right){\Delta _r}H_{298}^0 = + 180\;kJ$
Phát biểu nào sau đây đúng?
A. Cho $2\;mol\;{N_2}$ tác dụng với $1\;mol{O_2}$ thu vào nhiệt lượng là $180\;kJ$.
B. Cho 1 mol ${N_2}$ tác dụng với 1 mol $O2$ thu vào nhiệt lượng là $180\;kJ$.
C. Cho $1\;mo{l_2}$ tác dụng với ${O_2}$ dư thu vào nhiệt lượng là $180\;kJ$.
D. Cho $1\;mol\;{N_2}$ tác dụng với $1\;mol\,{o_2}$ toả nhiệt lượng là $180\;kJ$.
Câu 7. Số oxi hóa của $S$ trong $S{O_2}$ là
A. +4 B. +6 C. -1 D. +2
Câu 8. Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất là
A. lượng nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
B. Iượng nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 2 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
C. Iượng nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền nhất ở điều kiện chuẩn.
D. lượng nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Câu 9. Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số khối. B. Số proton. C. Số mol. D. Số oxi hóa.
Câu 10. Dẫn khí ${H_2}$ đi qua ống sứ đựng bột $CuO$ nung nóng để thực hiện phản ứng hóa học sau:
$CuO + {H_2}\xrightarrow{{{t^0}}}Cu + {H_2}O$. Trong phản ứng trên, chất đóng vai trò chất khử là
A. CuO. B. ${H_2}$. C. $Cu$. D. ${H_2}O$.
Câu 11. Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:
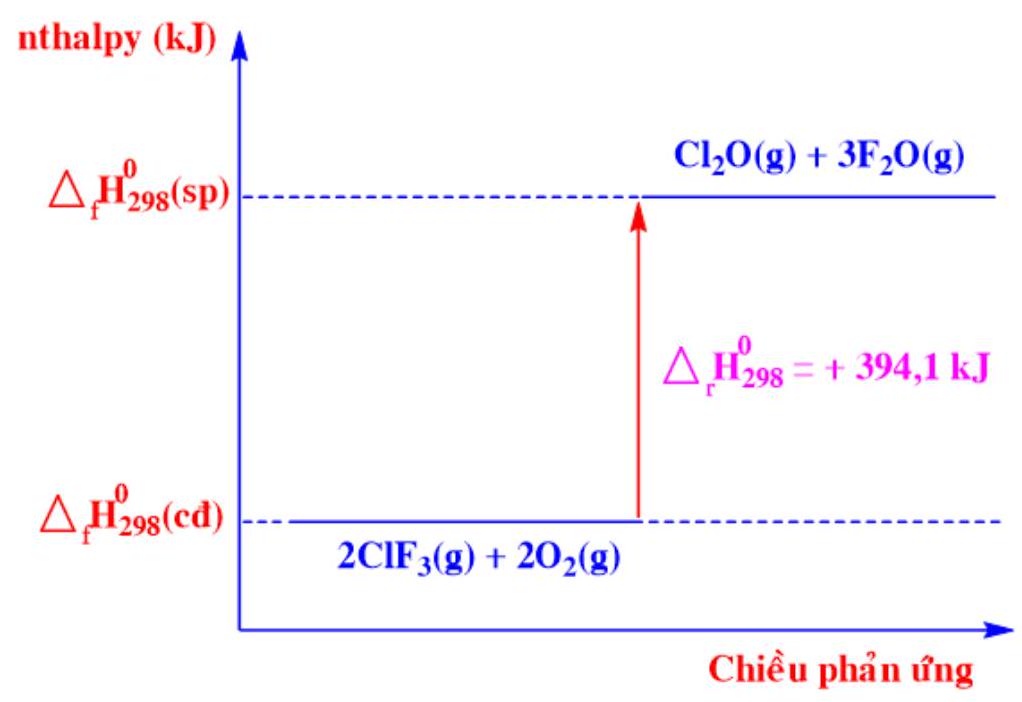
A. $C{l_2}O\left( g \right) + 3\;{F_2}O\left( g \right) \to 2Cl{F_3}\left( {\;g} \right) + 2{O_2}$ ${\Delta _r}H_{298}^0 = – 394,10\;kJ$
B. $C{l_2}O\left( g \right) + 3\;{F_2}O\left( g \right) \to 2Cl{F_3}\left( {\;g} \right) + 2{O_2}$ ${\Delta _r}H_{298}^0 = + 394,10\;kJ$
C. $2Cl{F_3}\left( {\;g} \right) + 2{O_2}\left( {\;g} \right) \to C{l_2}O\left( g \right) + 3\;{F_2}O(g)$ ${\Delta _r}H_{298}^0 = + 394,10\;kJ$
D. $2Cl{F_3}\left( {\;g} \right) + 2{O_2}\left( g \right) \to C{l_2}O\left( g \right) + 3F{e_2}O\,(g)$ ${\Delta _r}H_{298}^0 = – 394,10\;kJ$
Câu 12. Cho phản ứng hóa học: $Fe + CuS{O_4} \to FeS{O_4} + Cu$.
Trong phản ứng trên xảy ra
A. sự khử $F{e^{2 + }}$ và sự oxi hóa $Cu$. B. sự khử $F{e^{2 + }}$ và sự khử $C{u^{2 + }}$.
C. sự oxi hóa Fe và sự oxi hóa Cu. D. sự oxi hóa Fe và sự khử $C{u^{2 + }}$.
Câu 13. Hydrogen phản ứng với chlorine để tạo thành hydrogen chloride theo phương trình ${H_2}\left( {\;g} \right) + C{l_2}\left( {\;g} \right) \to 2HCl\left( g \right)$. Biến thiên enthalpy chuẩn của phản ứng là
(Biết năng hrợng liên kết ${E_{\left( {H – H} \right)}} = 436\;kJ/mol,{E_{\left( {Cl – Cl} \right)}} = 243\;kJ/mol,{E_{\left( {H – Cl} \right)}} = 432\;kJ/mol$ ).
A. $ – 185\;kJ/mol$. B. $ + 92,5\;kJ/mol$. C. $ – 92,5\;kJ/mol$. D. $ + 185\;kJ/mol$.
Câu 14. Chất nào sau đây có tính oxi hóa?
A. Fe. B. $Na$. C. ${O_2}$. D. Ca.
Câu 15. Cho quá trình ${N^{ + 5}} + 3e \to {N^{ + 2}}$, đây là quá trình
A. khử. B. oxi hóa. C. tự oxi hóa – khử. D. nhận proton.
Câu 16. Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất có kí hiệu là
A. ${\Delta _f}H_{298}^0$. B. ${\Delta _r}H$. C. ${\Delta _r}H_{298}^0$. D. $\Delta H$.
Câu 17. Công thức tính biến thiên enthalpy chuẩn của phản ứng theo năng lượng liên kết là
A. ${\Delta _r}H_{298}^0 = \Sigma {E_b}\left( {cn} \right) + \Sigma {E_b}\left( {sp} \right)$. B. ${\Delta _r}H_{298}^0 = \Sigma {E_b}\left( {sp} \right) – \Sigma {E_b}\left( {cn} \right)$.
C. ${\Delta _f}H_{298}^0 = \Sigma {E_b}\left( {cn} \right) \times \Sigma {E_b}\left( {sp} \right)$. D. ${\Delta _r}H_{298}^0 = \Sigma {E_b}($ cn $) – \Sigma {E_b}($ sp $)$.
Câu 18. Cho phương trình nhiệt hóa học của phản ứng:
$2{H_2}\left( {\;g} \right) + {O_2}\left( {\;g} \right) \to \;2{H_2}O\,\,\left( l \right)\;{\Delta _r}H_{298}^0 = – 571,68\;kJ$
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Trong phản ứng oxi hóa – khử
a. chất bị oxi hóa nhận e và chất bị khử cho e.
b. quá trình oxi hóa và quá trình khử xảy ra đồng thời.
c. chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
d. quá trình nhận e gọi là quá trình oxi hóa.
Câu 2. Để hàn nhanh đường ray tàu hỏa bị hỏng, người ta dùng hỗn hợp tecmit để thực hiện phản ứng nhiệt nhôm theo sơ đồ phản ứng: $Al + F{e_2}{O_3}\xrightarrow{{{t^0}}}A{l_2}{O_3} + Fe$.
a. Al là chất bị khử.
b. $F{e_2}{O_3}$ là chất oxi hóa.
c. Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 2:1.
d. Phản ứng tỏa rất nhiều nhiệt.
Câu 3. Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
${N_2}\left( {\;g} \right) + {O_2}\left( {\;g} \right)\; \to 2NO\left( g \right)\;{\Delta _r}H = + 180\;kJ$
a. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
b. Phản ứng tỏa nhiệt.
c. Phản ứng xảy ra thuận lợi ở điều kiện thường.
d. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Câu 4. Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ ${25^ \circ }C$, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình ” $S\left( s \right) + {O_2}\left( {\;g} \right) \to S{O_2}\left( {\;g} \right)$ ” và tỏa ra một lượng nhiệt là 196,9kJ.
a. Biến thiên enthalpy chuẩn của phản ứng là $296,9\;kJ\;mo{l^{ – 1}}$
b. Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9kJ.
c. Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d. 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Cho phản ứng: $FeO + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O$. Trong phương trình của phản ứng trên, khi hệ số của $FeO$ là 3 thì hệ số của $HN{O_3}$ là bao nhiêu?
Câu 2. Cho các phản ứng sau đây:
(1) $FeS + 2HCl \to FeC{l_2} + {H_2}S$
(2) $2{H_2}\;S + S{O_2} \to 3\;S + 2{H_2}O$
(3) $CaO + C{O_2} \to CaC{O_3}$
(4) $2KI + {H_2}O + {O_3} \to 2KOH + {I_2} + {O_2}$
(5) $2KCl{O_3}\xrightarrow{{{t^0}}}2KCl + 3{O_2}$
Có bao nhiêu phản ứng đã cho thuộc loại phản ứng oxi hoá – khử?
Câu 3. Cho các quá trình (phản ứng) sau đây:
(1) ${H_2}O$ (lỏng, ở ${25^ \circ }C$ ) $ \to {H_2}O$ (hơi, ở ${100^ \circ }C$ ).
(2) ${H_2}O$ (lỏng, ở ${25^ \circ }C$ ) $ \to {H_2}O$ (rắn, ở ${0^ \circ }C$ ).
(3) $CaC{O_3}$ (Đá vôi) $\xrightarrow{{Nung}}CaO + C{O_2}$.
(4) Khí methane $\left( {C{H_4}} \right)$ cháy trong oxygen.
Có bao nhiêu quá trình (phản ứng) sau đây là tỏa nhiệt?
Câu 4. Cho từng chất: $Fe,FeO,Fe{(OH)_2},$$Fe{(OH)_3},F{e_3}{O_4},F{e_2}{O_3},$$Fe{\left( {N{O_3}} \right)_2},Fe{\left( {N{O_3}} \right)_3}$$,FeS{O_4},F{e_2}{\left( {S{O_4}} \right)_3}$, $FeC{O_3}$ lần lượt phản ứng với $HN{O_3}$ đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá – khử là bao nhiêu?
Câu 5. Hòa tan 14 gam Fe trong dung dịch ${H_2}S{O_4}$ loãng, dư thu được dung dịch $X$. Thêm dung dịch $KMn{O_4}1M$ vào dung dịch $X$. Biết $KMn{O_4}$ có thể oxi hóa $FeS{O_4}$ trong môi trường ${H_2}S{O_4}$ thành $F{e_2}{\left( {S{O_4}} \right)_3}$ và bị khử thành $MnS{O_4}$. Phản ứng xảy ra hoàn toàn. Tính thể tích dung dịch $KMn{O_4}1M$ dã phản ứng.(Cho biết NTK của Fe=56) (Làm tròn kết quả đến hàng phần miời)
Câu 6. Phản ứng đốt cháy methane xảy ra như sau:
$C{H_4}\left( {\;g} \right) + 2{O_2}\left( {\;g} \right)\; – C{O_2}\left( {\;g} \right) + 2{H_2}O\left( I \right)$
Biết enthalpy tạo thành chuẩn của các chất $C{H_4}\left( {\;g} \right) = – 74,8\;kJ/mol;C{O_2}\left( {\;g} \right) = – 393,5\;kJ/mol$;
${H_2}O\left( I \right) = – 285,8\;kJ/mol$. Tính biến thiên enthalpy chuẩn của phản ứng.(Làm tròn kết quả đến hàng phần mười)
ĐÁP ÁN VÀ LỜI GIẢI
PHẦN I (4,5 đ). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Mỗi câu trả lời đúng thí sinh được 0,25 đ
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| ĐA | C | B | B | A | D | B | A | D | D | B | C | D | A | C | A | A | D | B |
PHẦN II (4 đ). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
-Điểm tối đa của 01 câu hỏi là 1 điểm
-Thí sinh lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm
-Thí sinh lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm
-Thí sinh lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm
-Thí sinh lựa chọn chính xác 04 ý trong 1 câu hỏi được 1 điểm
| Câu | Lệnh hỏi | Đáp án (Đ/S) |
Câu | Lệnh hỏi | Đáp án (Đ/S) |
| 1 | a | S | 3 | a | S |
| b | Đ | b | S | ||
| c | S | c | S | ||
| d | S | d | Đ | ||
| 2 | a | S | 4 | a | S |
| b | Đ | b | Đ | ||
| c | S | c | Đ | ||
| d | Đ | d | Đ |
PHẦN III (1,5 đ): Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Mỗi câu đúng 1,5 điểm
Mỗi câu trả lời đúng thí sinh được 0,25 điểm
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| ĐA | 10 | 3 | 2 | 7 | 50 | -890,3 |
HƯỚNG DẪN GIẢI
PHẦN I.
PHẦN II.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Cho phản ứng: $FeO + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O$. Trong phương trình của phản ứng trên, khi hệ số của $FeO$ là 3 thì hệ số của $HN{O_3}$ là bao nhiêu?
Hướng dẫn giải
$3FeO + 10HN{O_3} \to 3Fe{\left( {N{O_3}} \right)_3} + NO + 5{H_2}O$
Đáp án là 10
Câu 2. Cho các phản ứng sau đây:
(1) $FeS + 2HCl \to FeC{l_2} + {H_2}S$
(2) $2{H_2}\;S + S{O_2} \to 3\;S + 2{H_2}O$
(3) $CaO + C{O_2} \to CaC{O_3}$
(4) $2KI + {H_2}O + {O_3} \to 2KOH + {I_2} + {O_2}$
(5) $2KCl{O_3}\xrightarrow{{{t^0}}}2KCl + 3{O_2}$
Có bao nhiêu phản ứng đã cho thuộc loại phản ứng oxi hoá – khử?
Đáp án là 3
Câu 3. Cho các quá trình (phản ứng) sau đây:
(1) ${H_2}O$ (lỏng, ở ${25^ \circ }C$ ) $ \to {H_2}O$ (hơi, ở ${100^ \circ }C$ ).
(2) ${H_2}O$ (lỏng, ở ${25^ \circ }C$ ) $ \to {H_2}O$ (rắn, ở ${0^ \circ }C$ ).
(3) $CaC{O_3}$ (Đá vôi) $\xrightarrow{{Nung}}CaO + C{O_2}$.
(4) Khí methane $\left( {C{H_4}} \right)$ cháy trong oxygen.
Có bao nhiêu quá trình (phản ứng) sau đây là tỏa nhiệt?
Hướng dẫn giải
Đáp án là 2
Câu 4. Cho từng chất: $Fe,FeO,Fe{(OH)_2},$$Fe{(OH)_3}$$,F{e_3}{O_4}$$,F{e_2}{O_3},$$Fe{\left( {N{O_3}} \right)_2}$$,Fe{\left( {N{O_3}} \right)_3}$,$FeS{O_4}$$,F{e_2}{\left( {S{O_4}} \right)_3}$, $FeC{O_3}$ lần lượt phản ứng với $HN{O_3}$ đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá – khử là bao nhiêu?
Đán áp là 7
Hướng dẫn giải
Câu 5. Hòa tan 14 gam $Fe$ trong dung dịch ${H_2}S{O_4}$ loãng, dư thu được dung dịch $X$. Thêm dung dịch $KMn{O_4}1M$ vào dung dịch $X$. Biết $KMn{O_4}$ có thể oxi hóa $FeS{O_4}$ trong môi trường ${H_2}S{O_4}$ thành $F{e_2}{\left( {S{O_4}} \right)_3}$ và bị khử thành $MnS{O_4}$. Phản ứng xảy ra hoàn toàn. Tính thể tích dung dịch $KMn{O_4}1M$ dã phản ứng. (Cho biết $NTK$ của $Fe = 56$ ) (Làm tròn kết quả đến hàng phần muời)
Hướng dẫn giải
Ta có: ${n_{Fe}} = 0,25\;mol$
$\begin{gathered}
Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \hfill \\
0,25\;mol\; \to 0,25\;mol \hfill \\
\end{gathered} $
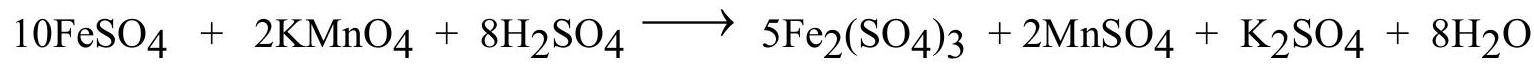
$0,25\;mol \to 0,05\;mol$
$ \Rightarrow {V_{dung\;dich\;}}KMnO4 = 0,05:1 = 0,05\;L = 50\;mL$.
Đáp án là 50
Câu 6. Phản ứng đốt cháy methane xảy ra như sau:
$C{H_4}\left( {\;g} \right) + 2{O_2}\left( {\;g} \right)\xrightarrow{{{t^0}}}C{O_2}\left( {\;g} \right) + 2{H_2}O\left( l \right)$
Biết enthalpy tạo thành chuẩn của các chất $C{H_4}\left( {\;g} \right) = – 74,8\;kJ/mol;C{O_2}\left( {\;g} \right) = – 393,5\;kJ/mol$;
${H_2}O\left( l \right) = – 285,8\;kJ/mol$. Tính biến thiên enthalpy chuẩn của phản ứng. (Làm tròn kết quả đến hàng phần mười)
Hướng dẫn giải
${\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0\left( {C{O_2}\left( {\;g} \right)} \right) + 2{\Delta _f}H_{298}^0\left( {{H_2}O\left( l \right)} \right)$
$ – {\Delta _f}H_{298}^0\left( {C{H_4}\left( {\;g} \right)} \right) – 2{\Delta _f}H_{298}^0\left( {{O_2}\left( {\;g} \right)} \right)$
$ = \left( { – 393,5} \right) + 2 \cdot \left( { – 285,8} \right) – \left( { – 74,8} \right) – 2.0 = – 890,3\left( {\;kJ} \right)$
Đáp án là $ – 890,3$








