- Đề Thi Giữa Học Kỳ 2 Hóa 10 Năm 2022-2023 Có Đáp Án-Đề 1
- Đề Thi Giữa Học Kỳ 2 Hóa 10 Chân Trời Sáng Tạo Có Đáp Án-Đề 2
- Bộ Đề Ôn Tập Giữa Học Kỳ 2 Hóa 10 Chân Trời Sáng Tạo Năm 2022-2023
- Đề Kiểm Tra Giữa Học Kỳ 2 Hóa 10 Sở GD Bắc Ninh 2022-2023 Có Đáp Án
- Đề Cương Ôn Tập Giữa HK2 Hóa 10 Chân Trời Sáng Tạo 2022-2023
- Đề Cương Ôn Tập Hóa 10 Giữa HK2 Năm Học 2022-2023
- Đề Thi Giữa HK2 Hóa 10 Chân Trời Sáng Tạo Cấu Trúc Mới Giải Chi Tiết-Đề 1
- Đề Thi Giữa Học Kỳ 2 Hóa 10 CTST Cấu Trúc Mới Giải Chi Tiết-Đề 2
- Đề Thi Giữa HK2 Hóa 10 Kết Nối Tri Thức Cấu Trúc Mới Giải Chi Tiết
- Đề Kiểm Tra Giữa Học Kỳ 2 Hóa 10 Kết Nối Tri Thức Cấu Trúc Mới Giải Chi Tiết-Đề 2
- Đề Thi Giữa Học Kỳ 1 Hóa 10 Cánh Diều Cấu Trúc Mới Giải Chi Tiết
- Đề Cương Ôn Giữa HK2 Hóa 10 Chân Trời Sáng Tạo 2023-2024 Theo Từng Bài Học
- Đề Thi Giữa Kỳ 2 Hóa 10 Kết Nối Tri Thức 2023-2024 Có Ma Trận Đặc Tả
Đề thi giữa học kỳ 2 Hóa 10 CTST cấu trúc mới giải chi tiết-Đề 2 được soạn dưới dạng file word và PDF gồm 5 trang. Các bạn xem và tải về ở dưới.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Trường hợp nào sau đây là quá trình chuyển hóa từ hóa năng thành nhiệt năng?
A. Than được đốt để đun sôi nước.
B. Nước đá bốc hơi trong phòng kín.
C. Hòa tan đường saccharose với nước cất.
D. Sử dụng pin mặt trời trong đời sống.
Câu 2. Số oxi hóa của Mn trong KMnO4 là
A. +4. B. -3. C. +7. D. +3.
Câu 3. Phản ứng nào dưới đây là phản ứng tỏa nhiệt?
A. Quá trình nung đá vôi.
B. Phản ứng phân hủy postassium chlorate (KClO3).
C. Phản ứng của hydrochloric acid với sodium hydroxide.
D. Phản ứng nhiệt phân ammonium chloride (NH4Cl)
Câu 4. Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) → 2H2O(l) ${\Delta _r}H_{298}^0 = – 571,68kJ$
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu 5. Trong phản ứng tỏa nhiệt, biến thiên enthalpy chuẩn luôn nhận giá trị
A. bằng 0. B. âm. C. có thể âm có thể dương. D. dương.
Câu 6. Trong phản ứng thu nhiệt, sự so sánh nào sau đây đúng về $\sum {{\Delta _f}} H_{298}^0(c\;d)$ và $\sum {{\Delta _f}} H_{298}^0(sp)$
A. $\sum {{\Delta _f}} H_{298}^0(\;cd) \simeq \sum {{\Delta _f}} H_{298}^0(sp)$.
B. $\sum {{\Delta _f}} H_{298}^0(\;cd) < \sum {{\Delta _f}} H_{298}^0(sp)$.
C. $\sum {{\Delta _f}} H_{298}^0(\;cd) \simeq \sum {{\Delta _f}} H_{298}^0(sp)$.
D. $\sum {{\Delta _f}} H_{298}^0(\;cd) > \sum {{\Delta _f}} H_{298}^0(sp)$.
Câu 7. Trong phản ứng: 2Fe3O4 + 10H2SO4 đặc$\xrightarrow{{{t^0}}}$3Fe2(SO4)3 + SO2 + 10H2O thì H2SO4 đóng vai trò là
A. chất oxi hóa. B. chất khử. C. chất oxi hoá và môi trường. D. chất khử và môi trường.
Câu 8. Loại phản ứng nào sau đây cần phải cung cấp năng lượng trong quá trình phản ứng?
A. Phản ứng tạo gỉ kim loại.
B. Phản ứng trung hòa giữa dung dịch acid mạnh với dung dịch base mạnh
C. Phản ứng nhiệt phân.
D. Phản ứng đốt cháy.
Câu 9. Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) của một chất có kí hiệu là
A. ${\Delta _r}H_{298}^0$. B. ${\Delta _f}H_{298}^0$. C. $\Delta S$. D. $\Delta T$.
Câu 10. Trong không khí ẩm, Fe(OH)2 màu trắng xanh chuyển dần thành Fe(OH)3 màu nâu đỏ theo phương trình: 4Fe(OH)2 + O2 +2 H2O → 4Fe(OH)3. Chất nhường electron trong phản ứng trên là
A. Fe(OH)3 B. O2. C. H2O D. Fe(OH)2
Câu 11. Khi hòa tan ammonium nitrate vào nước, nhiệt độ của nước giảm. Phát biểu nào dưới đây giải thích đúng cho quá trình được miêu tả ở trên?
A. Ammonium nitrate phản ứng với nước và quá trình này là phản ứng tỏa nhiệt.
B. Ammonium nitrate phản ứng với nước và quá trình này là phản ứng thu nhiệt.
C. Ammonium nitrate tan trong nước và quá trình này là phản ứng tỏa nhiệt.
D. Ammonium nitrate tan được trong nước và quá trình này là phản ứng thu nhiệt.
Câu 12. Phản ứng thu nhiệt là gì?
A. Là một loại phản ứng hóa học trong đó xảy ra sự hấp thụ năng lượng thường là nhiệt năng từ môi trường bên ngoài vào bên trong quá trình phản ứng.
B. Là năng lượng cần thiết để phá vỡ liên kết đó tạo thành nguyên tử ở thể khí.
C. Là một loại phản ứng hóa học trong đó xảy ra sự truyền năng lượng, chủ yếu dưới dạng giải phóng nhiệt hoặc ánh sáng ra môi trường bên ngoài.
D. Là tổng năng lượng liên kết trong phân tử của chất đầu và sản phẩm phản ứng.
Câu 13. Phản ứng (quá trình) nào sau đây thu nhiệt?
A. Hoà tan KBr vào nước làm cho nước trở nên lạnh đi.
B. Nước hoá rắn.
C. Phản ứng cháy của acetylene.
D. Khi CH4 đốt ở trong lò.
Câu 14. Phương trình nhiệt hoá học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) →2NO(g) ${\Delta _r}H_{298}^0 = + 180\,kJ$
Kết luận nào sau đây đúng?
A. Phản ứng hoá học xảy ra có sự hấp thụ nhiệt từ môi trường.
B. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
C. Phản ứng tỏa nhiệt.
D. Phản ứng xảy ra thuận lợi ở điều kiện thường.
Câu 15. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ sau:
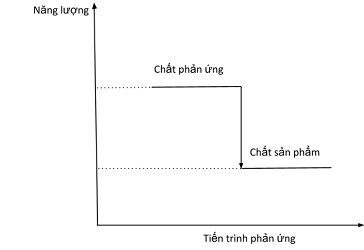
Kết luận nào sau đây là đúng?
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.
D. Phản ứng thu nhiệt.
Câu 16. Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của HCl là
A. chất oxi hóa. B. chất khử.
C. tạo môi trường. D. chất khử và môi trường.
Câu 17. Cho quá trình N+5 + 3e → N+2, đây là quá trình
A. khử. B. oxi hóa. C. tự oxi hóa – khử. D. nhận proton.
Câu 18. Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hoá học:
Cl2 + 2NaBr → 2NaCl + Br2
Trong phản ứng hoá học trên, xảy ra quá trình oxi hoá chất nào?
A. NaCl. B. Br2. C. Cl2. D. NaBr.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn sau đây tỏa ra 184,6 kJ:
H2(g) + Cl2(g) → 2HCl(g) (*)
a. Nhiệt tạo thành chuẩn của HCl là –184,6 kJ/mol.
b. Biến thiên enthalpy chuẩn phản ứng (*) là –184,6 kJ.
c. Phản ứng (*) diễn ra thuận lợi.
d. Về mặt năng lượng HCl(g) bền hơn so với các đơn chất bền tạo nên nó.
Câu 2. Phản ứng hóa học khi xảy ra kèm theo sự giải phóng hoặc hấp thu năng lượng, năng lượng này gọi là năng lượng hóa học.
a. Nến (parafin) cháy trong không khí là phản ứng tỏa nhiệt.
b. Phản ứng thủy phân collagen thành gelatin diễn ra khi hầm xương động vật là phản ứng thu nhiệt.
c. Hầu hết các phản ứng thu nhiệt chỉ cần khơi mào thì phản ứng có thể tiếp tục xảy ra.
d. Tất cả các phản ứng tỏa nhiệt có thể tự xảy ra mà không cần khơi mào.
Câu 3. Xăng (octane – C8H18) là một loại nhiên liệu được sử dụng cho nhiều loại phương giao thông như xe máy, xe ôtô, tàu hỏa,… Khi xăng cháy, nếu oxygen dư thì sự cháy hoàn toàn và cho sản phẩm là CO2 và H2O, nếu thiếu oxygen thì sự cháy xảy ra không hoàn toàn và một phần carbon chuyển thành CO, còn khi rất thiếu oxygen thì chỉ tạo ra nước và để lại muội là carbon.
a. Phản ứng cháy của xăng là phản ứng tỏa nhiệt.
b. Phản ứng cháy của xăng (octane – C8H18) trong điều kiện dư oxygen sẽ tiết kiệm năng lượng hơn điều kiện thiếu oxygen.
c. Trong điều kiện cháy dư oxygen thì mỗi phân tử C8H18 nhường 34 electron.
d. CO loại khí độc và gây ô nhiễm môi trường.
Câu 4. Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate: $FeS{O_4} + KMn{O_4} + {H_2}S{O_4} \to F{e_2}{\left( {S{O_4}} \right)_3} + {K_2}S{O_4} + MnS{O_4} + {H_2}O$
a. Vai trò của H2SO4 trong phản ứng vừa là chất oxi hóa, vừa là chất tạo môi trường acid.
b. Nguyên tố Fe trong FeSO4 đóng vai trò là chất bị khử.
c. Nếu hệ số của FeSO4 là 10 thì hệ số của H2SO4 là 18.
d. Thể tích KMnO4 0,02M để phản ứng vừa đủ 20 mL dd FeSO4 0,1M là 20 mL.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Có bao nhiêu phản ứng hóa học tỏa nhiệt trong số các phản ứng sau?
ZnSO4(s) → ZnO(s) + SO3(g) ${\Delta _r}H_{298}^0 = + 235,21\,kJ$ (1)
3H2(g) + N2(g) → 2NH3(g) ${\Delta _r}H_{298}^0 = – 91,8\,kJ$ (2)
2H2S(g) + SO2(g)→ 2H2O(g) + 3S(s) ${\Delta _r}H_{298}^0 = – 237\,kJ$ (3)
H2O(g) →H2 + 1/2O2(g) ${\Delta _r}H_{298}^0 = + 241,8\,kJ$ (4)
Câu 2. Có bao nhiêu chất vừa là chất khử, vừa là chất oxi hóa trong số các chất sau: Mg, FeO, S, SO2, HCl, H2SO4.
Câu 3. Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ${\Delta _r}H_{298}^0 = — 890,3\,kJ$
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 và –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là bao nhiêu. (Làm tròn kết quả đến hàng phần mười)
Câu 4. Tiêu chuẩn quốc gia GB 14880 – 1994 quy định hàm lượng iodine có trong muối iodine là từ 20 – 60 mg/kg. Để kiểm tra hàm lượng potassium iodide trong muối ăn có đạt tiêu chuẩn hay không có thể sử dụng phản ứng sau: KIO3 + KI + H2SO4 → K2SO4 + I2 + H2O.
Nếu cần tạo ra 0,3 mol iodine thì khối lượng muối KIO3 cần dùng là bao nhiêu gam? (Cho biết NTK: K=39, I=127, O=16) (Làm tròn kết quả đến hàng phần mười)
Câu 5. Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
| Liên kết | C – H | C – C | C = C |
| Eb (kJ/mol) | 418 | 346 | 612 |
Biến thiên enthalpy chuẩn của phản ứng C3H8(g) → CH4(g) + C2H4(g) là bao nhiêu? (Làm tròn kết quả đến hàng phần mười)
Câu 6. Có bao nhiêu phản ứng mà trong đó HCl đóng vai trò là chất khử trong số các phản ứng sau?
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
ĐÁP ÁN VÀ LỜI GIẢI
PHẦN I (4,5 đ). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án. Mỗi câu trả lời đúng thí sinh được 0,25 đ
| 1 | 2 | 3 | 4 | 5 | 6 |
| A | C | C | C | B | B |
| 7 | 8 | 9 | 10 | 11 | 12 |
| C | C | B | D | D | A |
| 13 | 14 | 15 | 16 | 17 | 18 |
| A | A | A | D | A | D |
PHẦN II (4 đ). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
-Điểm tối đa của 01 câu hỏi là 1 điểm
-Thí sinh lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm
-Thí sinh lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm
-Thí sinh lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm
-Thí sinh lựa chọn chính xác 04 ý trong 1 câu hỏi được 1 điểm
| Câu | Lệnh hỏi | Đáp án (Đ/S) |
Câu | Lệnh hỏi | Đáp án (Đ/S) |
| 1 | a | S | 3 | a | Đ |
| b | Đ | b | Đ | ||
| c | Đ | c | S | ||
| d | Đ | d | Đ | ||
| 2 | a | Đ | 4 | a | S |
| b | Đ | b | S | ||
| c | S | c | S | ||
| d | S | d | Đ |
PHẦN III (1,5 đ): Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6. Mỗi câu đúng 1,5 điểm
Mỗi câu trả lời đúng thí sinh được 0,25 điểm
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| ĐA | 2 | 4 | -74,8 | 24,1 | 80 | 2 |
HƯỚNG DẪN GIẢI
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 3. Xăng (octane – C8H18) là một loại nhiên liệu được sử dụng cho nhiều loại phương giao thông như xe máy, xe ôtô, tàu hỏa,… Khi xăng cháy, nếu oxygen dư thì sự cháy hoàn toàn và cho sản phẩm là CO2 và H2O, nếu thiếu oxygen thì sự cháy xảy ra không hoàn toàn và một phần carbon chuyển thành CO, còn khi rất thiếu oxygen thì chỉ tạo ra nước và để lại muội là carbon.
a. Phản ứng cháy của xăng là phản ứng tỏa nhiệt. → Đ
b. Phản ứng cháy của xăng (octane – C8H18) trong điều kiện dư oxygen sẽ tiết kiệm năng lượng hơn điều kiện thiếu oxygen. → Đ
c. Trong điều kiện cháy dư oxygen thì mỗi phân tử C8H18 nhường 34 electron. → S
Hướng dẫn giải
$C_8^{ – 188} \to 8{C^{ + 4}} + 50e$
d. CO loại khí độc và gây ô nhiễm môi trường. → Đ
Câu 4. Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate: $FeS{O_4} + KMn{O_4} + {H_2}S{O_4} \to F{e_2}{\left( {S{O_4}} \right)_3} + {K_2}S{O_4} + MnS{O_4} + {H_2}O$
a. Vai trò của H2SO4 trong phản ứng vừa là chất oxi hóa, vừa là chất tạo môi trường acid. → S
b. Nguyên tố Fe trong FeSO4 đóng vai trò là chất bị khử. → S
c. Nếu hệ số của FeSO4 là 10 thì hệ số của H2SO4 là 18. → S
d. Thể tích KMnO4 0,02M để phản ứng vừa đủ 20 mL dd FeSO4 0,1M là 20 mL. → Đ
Hướng dẫn giải
a. Vai trò của H2SO4 trong phản ứng là chất tạo môi trường acid.
b. Nguyên tố Fe trong FeSO4 đóng vai trò là chất khử.
+2 +7 +3 +2
c. 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Nếu hệ số của FeSO4 là 10 thì hệ số của H2SO4 là 8.
d. $10FeS{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{e_2}{\left( {S{O_4}} \right)_3} + {K_2}S{O_4} + 2MnS{O_4} + 8{H_2}O$
0,002 → 0,0004 mol
${V_{dd\,KMn{O_4}}} = \frac{{0,0004}}{{0,02}} = 0,02\;L = 20\;mL$
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Có bao nhiêu phản ứng hóa học tỏa nhiệt trong số các phản ứng sau?
ZnSO4(s) → ZnO(s) + SO3(g) ${\Delta _r}H_{298}^0 = + 235,21\,kJ$ (1)
3H2(g) + N2(g) → 2NH3(g) ${\Delta _r}H_{298}^0 = – 91,8\,kJ$ (2)
2H2S(g) + SO2(g)→ 2H2O(g) + 3S(s) ${\Delta _r}H_{298}^0 = – 237\,kJ$ (3)
H2O(g) →H2 + 1/2O2(g) ${\Delta _r}H_{298}^0 = + 241,8\,kJ$ (4)
Đáp án là 2
Câu 2. Có bao nhiêu chất vừa là chất khử, vừa là chất oxi hóa trong số các chất sau: Mg, FeO, S, SO2, HCl, H2SO4.
Đáp án là 4
Câu 3. Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ${\Delta _r}H_{298}^0 = — 890,3\,kJ$
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 và –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là bao nhiêu. (Làm tròn kết quả đến hàng phần mười)
Đáp án là -74,8
Hướng dẫn giải
${\Delta _r}H_{298}^0 = {\Delta _f}H_{298\left( {C{O_2}(g)} \right)}^0 + 2{\Delta _f}H_{298\left( {{H_2}O(l)} \right)}^0 – {\Delta _f}H_{298\left( {C{H_4}(g)} \right)}^0 – {\Delta _f}H_{298\left( {{O_2}(g)} \right)}^0$
$ \Rightarrow – 890,3 = – 393,5 + 2.( – 285,8) – {\Delta _f}H_{298\left( {C{H_4}} \right)}^0$
$ \Rightarrow {\Delta _f}H_{298\left( {C{H_4}(\;g)} \right)}^0 = – 74,8(\;kJ/mol)$
Câu 4. Tiêu chuẩn quốc gia GB 14880 – 1994 quy định hàm lượng iodine có trong muối iodine là từ 20 – 60 mg/kg. Để kiểm tra hàm lượng potassium iodide trong muối ăn có đạt tiêu chuẩn hay không có thể sử dụng phản ứng sau: KIO3 + KI + H2SO4 → K2SO4 + I2 + H2O.
Nếu cần tạo ra 0,3 mol iodine thì khối lượng muối KIO3 cần dùng là bao nhiêu gam? (Cho biết NTK: K=39, I=127, O=16) (Làm tròn kết quả đến hàng phần mười)
Đáp án là 21,4
Hướng dẫn giải
KIO3 + 5KI + 3H2SO4 → 3K2SO4 + 3I2 + 3H2O
0,1 mol ← 0,3 mol
${m_{KI{O_3}}} = 0,1 \cdot (39 + 127 + 16 \cdot 3) = 21,4gam$
Câu 5. Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
| Liên kết | C – H | C – C | C = C |
| Eb (kJ/mol) | 418 | 346 | 612 |
Biến thiên enthalpy chuẩn của phản ứng C3H8(g) → CH4(g) + C2H4(g) là bao nhiêu? (Làm tròn kết quả đến hàng phần mười)
Đáp án là 80
Hướng dẫn giải
${\Delta _r}H_{298}^0$=Eb(C3H8(g) – Eb(CH4(g) – Eb(C2H4(g)
=(2EC-C + 8EC-H) – 4EC-H –(EC=C + 4EC-H)
=(2.346 + 8.418) – 4.418 – (612 + 4.418) = +80 kJ
Câu 6. Có bao nhiêu phản ứng mà trong đó HCl đóng vai trò là chất khử trong số các phản ứng sau?
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Đáp án là 2







