- Trắc Nghiệm Xác Định Hệ Số Cân Bằng Hóa Học Lớp 11 Có Đáp Án
- Trắc Nghiệm Xác Định Đồng Độ Các Chất-Hiệu Suất Phản Ứng Hóa 11 Có Đáp Án
- Trắc Nghiệm Lý Thuyết Về Cân Bằng Hóa Học Lớp 11 Có Đáp Án
- Trắc Nghiệm Lý Thuyết Về Sự Điện Ly Acid Base Hóa 11 Có Đáp Án
- Trắc Nghiệm Định Luật Bảo Toàn Điện Tích Hóa 11 Có Lời Giải
- Trắc Nghiệm Xác Định Hằng Số Điện Li-Độ Điện Ly Hóa 11 Có Lời Giải
- Trắc Nghiệm Lý Thuyết Về Ph Dung Dịch-Chuẩn Độ Acid-Base Hóa 11 Có Lời Giải
- Trắc Nghiệm Xác Định pH Của Dung Dịch Hóa 11 Có Lời Giải
- Bài Tập Về Chuẩn Độ Acid-Base Hóa 11 Có Lời Giải
- Lý Thuyết Và Trắc Nghiệm Bài Khái Niệm Về Cân Bằng Hóa Học Lớp 11 Có Đáp Án
- Lý Thuyết Và Trắc Nghiệm Bài Cân Bằng Trong Dung Dịch Nước Lớp 11 Có Đáp Án
- Lý Thuyết Và Trắc Nghiệm Ôn Chương Cân Bằng Hóa Học Lớp 11 Có Đáp Án
Trắc nghiệm Xác định pH của dung dịch Hóa 11 có lời giải được soạn dưới dạng file word gồm 12 trang. Các bạn xem và tải về ở dưới.
TRẮC NGHIỆM VỀ XÁC ĐỊNH pH
I. LÝ THUYẾT CƠ BẢN
1. Xác định pH dung dịch
• Tính số ${\text{mol}}{{\text{H}}^ + }/{\text{O}}{{\text{H}}^ – }$ hoặc tổng số ${\text{mol}}{{\text{H}}^ + }/{\text{O}}{{\text{H}}^ – }$
• Tính nồng độ ${{\text{H}}^ + }/{\text{O}}{{\text{H}}^ – }$
• Áp dụng công thức tính ${\text{pH}}:{\text{pH}} = – {\text{lg}}\left[ {{{\text{H}}^ + }} \right]$
• Nếu là dung dịch base ta tính nồng độ ${\text{O}}{{\text{H}}^ – } \to {\text{pOH}} \to {\text{pH}} = 14 – {\text{pOH}}$
2. Phối trộn, pha loãng dung dịch
• Tính số mol acid, base
• Viết phương trình điện li
• Tính tổng số ${\text{mol}}{{\text{H}}^ + },{\text{O}}{{\text{H}}^ – }$
• Viết phương trình phản ứng trung hòa
• Xác định môi trường của dung dịch dựa vào ${\text{pH}} \to $ Xem xét mol aicd hay base dư
$ \to $ Tìm các giá trị mà bài toán yêu cầu.
Chú ý:
${{\text{V}}_{{\text{ddsaukhitron}}}} = {{\text{V}}_{{\text{acid}}}} + {{\text{V}}_{{\text{base}}}}$
3. Công thức tính gần đúng pH của acid và base yếu
• Công thức tính ${\text{pH}}$ gần đúng của một dung dịch acid yếu là:
${\text{pH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{a}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right)$
Trong đó: ${{\text{K}}_{\text{a}}}$ và ${{\text{C}}_{\text{M}}}$ là hằng số phân li acid và nồng độ acid.
-Công thức tính ${\text{pH}}$ gần đúng của một dung dịch base yếu là:
${\text{pOH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{b}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right) \to {\text{pH}} = 14 – {\text{pOH}}$
Trong đó: ${{\text{K}}_{\text{b}}}$ và ${{\text{C}}_{\text{M}}}$ là hằng số phân li base và nồng độ base.
Chú ý $p{K_a} = – \lg {K_a};\,p{K_b} = – \lg {K_b}$
II. VÍ DỤ MINH HỌA
Câu 1. Trộn $10{\text{g}}$ dung dịch ${\text{HCl}}7,3{\text{% }}$ với $20{\text{g}}$ dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}4,9{\text{% }}$ rồi thêm nước để được $100{\text{ml}}$ dung dịch ${\text{A}}$. Tính ${\text{pH}}$ của dung dịch ${\text{A}}$.
Lời giải
Số mol HCl là ${{\text{n}}_{{\text{HCl}}}} = \left( {10.7,3} \right)/\left( {100.36,5} \right) = 0,02{\text{mol}}$
Số ${\text{mol}}{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ là ${{\text{n}}_{{\text{H}}2}}{\text{S}}{{\text{O}}_4} = \left( {20.4,9} \right)/\left( {100.98} \right) = 0,01{\text{mol}}$
Phương trình điện ly: ${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
$\begin{array}{*{20}{r}}
{}&{0,02 \to 0,02{\text{mol}}} \\
{}&{{{\text{H}}_2}{\text{S}}{{\text{O}}_4} \to 2{{\text{H}}^ + } + {\text{S}}{{\text{O}}_4}{^{2 – }}} \\
{}&{0,01 \to 0,02{\text{mol}}}
\end{array}$
Tổng số ${\text{mol}}{{\text{H}}^ + }$là ${{\text{n}}_{\text{H}}}{^ + } = 0,02 + 0,02 = 0,04{\text{mol}}$
$\left[ {{{\text{H}}^ + }} \right] = 0,04/0,1 = 0,4{\text{M}} \to {\text{pH}} = 0,4$.
Câu 2. Hoà tan 3,66 gam hỗn hợp ${\text{Na}},{\text{Ba}}$ vào nước dư thu được $800{\text{ml}}$ dung dịch ${\text{A}}$ và 0,896 lít ${{\text{H}}_2}$ (đktc). Tính ${\text{pH}}$ của dung dịch ${\text{A}}$
Lời giải
${{\text{n}}_{{\text{H}}2}} = 0,896/22,4 = 0,04{\text{mol}}$
Gọi số mol của ${\text{Na}}$ và ${\text{Ba}}$ lần lượt là ${\text{x}},{\text{y}}$ mol.
Ta có: $23x + 137y = 3,66$
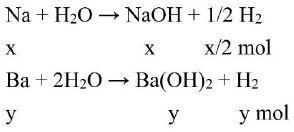
$ \to {\text{x}}/2 + {\text{y}} = 0,04$
Từ $\left( 1 \right),\left( 2 \right)$ ta có: ${\text{x}} = 0,04$ và ${\text{y}} = 0,02$
Phương trình điện ly:
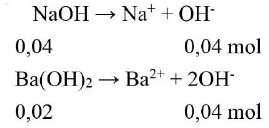
Tổng số ${\text{molO}}{{\text{H}}^ – }$là: ${\text{nO}}{{\text{H}}^ – } = 0,08{\text{mol}}$
$\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0,08/0,8 = 0,1{\text{M}} \to {\text{pOH}} = 1 \to {\text{pH}} = 13$
Câu 3. Hoà tan 1,07g ${\text{N}}{{\text{H}}_4}{\text{Cl}}$ vào nước được 2 lít dung dịch ${\text{X}}$.
a. Tính ${\text{pH}}$ của dung dịch ${\text{X}}$ biết hằng số phân li base của ${\text{N}}{{\text{H}}_3}$ là $1,8 \cdot {10^{ – 5}}$.
b. Nếu thêm vào dung dịch ${\text{X}}100{\text{ml}}$ dd ${\text{HCl}}$ 0,01 ${\text{M}}$ được dung dịch ${\text{Y}}$. Tính ${\text{pH}}$ của dung dịch Y?
Lời giải
a. ${{\text{n}}_{{\text{NH}}4{\text{Cl}}}} = 1,07/53,5 = 0,02 \to \left[ {{\text{N}}{{\text{H}}_4}{\text{Cl}}} \right] = 0,02/2 = 0,01{\text{M}}$
Phương trình điện ly:
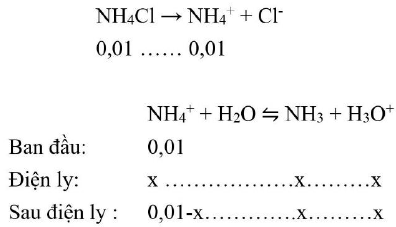
${{\text{K}}_{\text{b}}} = {{\text{x}}^2}/\left( {0,01 – {\text{x}}} \right) = 1,8 \cdot {10^{ – 5}} \to {\text{x}} = 4,24 \cdot {10^{ – 4}} \to {\text{pH}} = 3,37$
b. Phương trình điện ly:
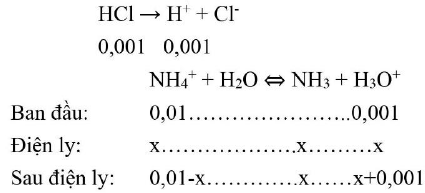
${{\text{K}}_{\text{b}}} = {\text{x}}\left( {{\text{x}} + 0,001} \right)/\left( {0,01 – {\text{x}}} \right) = 1,8 \cdot {10^{ – 5}} \to {\text{x}} = 3,69 \cdot 10 – 4 \to {\text{pH}} = 3,43$.
Câu 4. Trộn 3 dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}0,1{\text{M}};{\text{HN}}{{\text{O}}_3}0,2{\text{M}};{\text{HCl}}0,3{\text{M}}$ với thể tích bằng nhau thu được dung dịch ${\text{A}}$. Lấy $300{\text{ml}}$ dung dịch ${\text{A}}$ tác dụng với dung dịch ${\text{B}}$ gồm ${\text{NaOH}}0,2{\text{M}}$ và ${\text{Ba}}{({\text{OH}})_2}0,1{\text{M}}$. Tính thể tích dung dịch ${\text{B}}$ cần dùng để sau khi phản ứng kết thúc thu được dung dịch có ${\text{pH}} = 1$. ${\text{CoiBa}}{({\text{OH}})_2}$ và ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ phân li hoàn toàn ở 2 nấc.
Lời giải
Sau khi trộn 3 dung dịch acid có thể tích bằng nhau ta thu được nồng độ mới của 3 acid là: $\left[ {{\text{HCl}}} \right] = 0,1{\text{M}};\left[ {{\text{HN}}{{\text{O}}_3}} \right] = 0,2/3;\left[ {{{\text{H}}_2}{\text{S}}{{\text{O}}_4}} \right] = 0,1/3$.
Trong $300{\text{ml}}$ dung dịch ${\text{A}}:{{\text{n}}_{{\text{HCl}}}} = 0,03{\text{mol}};{{\text{n}}_{{\text{H}}2}}{\text{S}}{{\text{O}}_4} = 0,01{\text{mol}};{{\text{n}}_{{\text{HNO}}3}} = 0,02{\text{mol}}$ Phương trình điện ly:
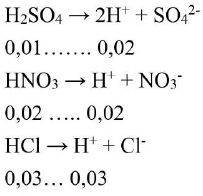
Tổng ${\text{mol}}{{\text{H}}^ + }$là ${{\text{n}}_{\text{H}}}{^ + } = 0,07{\text{mol}}$
Gọi $x$ là thể tích của dung dịch $B$ cần dùng. Khi đó ta có: ${{\text{n}}_{{\text{NaOH}}}} = 0,2{\text{x}};{{\text{n}}_{{\text{Ba}}\left( {{\text{OH}}} \right)2}} = 0,1{\text{x}}$
Phương trình điện ly:
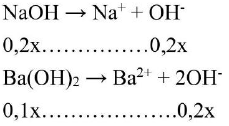
Tổng số ${\text{molO}}{{\text{H}}^ – }$là: ${\text{nO}}{{\text{H}}^ – } = 0,4{\text{x}}$
Ta có: ${\text{}}{{\text{H}}^ + } + {\text{O}}{{\text{H}}^ – } \to {{\text{H}}_2}{\text{O}}$ (Sau phản ứng ${\text{pH}} = 1 \to $ dư acid)

$\left( {0,07 – 0,4x} \right)/\left( {x + 0,3} \right) = 0,1 \to x = 0,08$ lít
III. BÀI TẬP TRẮC NGHIỆM
Câu 1. Dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}0,10{\text{M}}$ có
A. ${\text{pH}} = 1$
B. ${\text{pH}} < 1$
C. $\left[ {{{\text{H}}^ + }} \right] > 2,0{\text{M}}$
D. ${\text{pH}} > 1$
Câu 2. Trộn $200{\text{ml}}$ dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ 0,05M với 300ml dung dịch ${\text{HCl}}0,1{\text{M}}$ thu được dung dịch Y. pH của dung dịch ${\text{Y}}$ là:
A. 1,3
B. 4
C. 1
D. 3
Câu 3. Dung dịch ${\text{NaOH}}0,01{\text{M}}$ có giá trị ${\text{pH}}$ là
A. 2
B. 1
C. 13
D. 12
Câu 4. Dung dịch ${\text{X}}$ có ${\text{pH}} = 12$, thì $\left[ {{\text{O}}{{\text{H}}^ – }} \right]$của dung dịch là
A. $0,01{\text{M}}$
B. $1,2{\text{M}}$
C. $0,12{\text{M}}$
D. $0,20{\text{M}}$
Câu 5. Pha loãng dung dịch ${\text{HCl}}$ có ${\text{pH}} = 2$ bao nhiêu lần để được dung dịch có ${\text{pH}} = 3$ ?
A. 5 .
B. 100 .
C. 20 .
D. 10 .
Câu 6. Phải thêm bao nhiêu ${\text{ml}}$ nước vào $10{\text{ml}}$ dung dịch ${\text{NaOHpH}} = 12$ để được 1 dung dịch có ${\text{pH}} = 11$ ?
A. $90{\text{ml}}$
B. $10{\text{ml}}$
C. $20{\text{ml}}$
D. $50{\text{ml}}$
Câu 7. Trộn $300{\text{ml}}$ dung dịch ${\text{HCl}}0,05{\text{M}}$ với $200{\text{ml}}$ dung dịch ${\text{Ba}}{({\text{OH}})_2}{\text{aM}}$ thu được $500{\text{ml}}$ dung dịch có ${\text{pH}} = 12$. Giá trị của a là
A. 0,025
B. 0,05
C. 0,1
D. 0,5
Câu 8. ${\text{Z}}$ là dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}1{\text{M}}$. Để thu được dung dịch ${\text{X}}$ có ${\text{pH}} = 1$ cần phải thêm vào 1 lít dd ${\text{Z}}$ thể tích dung dịch ${\text{NaOH}}1,8{\text{M}}$ là
A. 1 lít.
B. 1,5 lít.
C. 3 lít.
D. 0,5 lít.
Câu 9. Trộn lẫn 3 dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}0,1{\text{M}};{\text{HN}}{{\text{O}}_3}0,2{\text{M}}$ và ${\text{HCl}}0,3{\text{M}}$ với những thể tích bằng nhau thu được dung dịch ${\text{A}}$. Tính ${\text{pH}}$ của dung dịch ${\text{A}}$ ?
A. 0,632 .
B. 0,362 .
C. 0,263.
D. 0,623 .
Câu 10. Trộn $100{\text{ml}}$ dung dịch ${\text{NaOH}}0,02{\text{M}}$ với 200ml dung dịch ${\text{KOH}}0,05{\text{M}}$ thu được dung dịch ${\text{X}}.{\text{pH}}$ của dung dịch ${\text{X}}$ là:
A. 1,40 .
B. 12,60 .
C. 2,67.
D. 11,33 .
Câu 11. Trộn lẫn $50{\text{ml}}$ dung dịch ${\text{Ba}}{({\text{OH}})_2}0,05{\text{M}}$ với $150{\text{ml}}$ dung dịch ${\text{HCl}}0,02{\text{M}}$ thu được dung dịch có ${\text{pH}}$ là:
A. 1
B. 12
C. 13
D. 2
Câu 12. Dung dịch ${\text{X}}$ gồm ${\text{Ba}}{({\text{OH}})_2}1{\text{M}}$ và ${\text{NaOH}}1{\text{M}}$; dung dịch ${\text{Y}}$ gồm ${\text{HCl}}0,125{\text{M}}$ và ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ 0,375M. Trộn $10{\text{ml}}$ dung dịch ${\text{X}}$ với $40{\text{ml}}$ dung dịch ${\text{Y}}$, được dung dịch ${\text{Z}}$. Giá trị ${\text{pH}}$ của ${\text{Z}}$ là:
A. 1 .
B. 12 .
C. 2 .
D. 13 .
Câu 13. ${\text{pH}}$ của dung dịch ${\text{HCl}}{10^{ – 7}}{\text{M}}$ là:
A. 7,00
B. 6,50
C. 6,79
D. 6,86
Câu 14. ${\text{pH}}$ của dung dịch ${\text{NaOH}}0,001{\text{M}}$ là
A. 3
B. 4
C. 11
D. 10
Câu 15. Tính ${\text{pH}}$ của $500{\text{ml}}$ dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$, biết rằng để trung hòa lượng acid trên cần vừa đủ $0,005{\text{molNaOH}}$ ?
A. 1
B. 2
C. 3
D. 4
Câu 16. Dung dịch ${\text{Ba}}{({\text{OH}})_2}0,01{\text{M}}$ có ${\text{pH}}$ bằng
A. ${\text{pH}} = 12,3$
B. ${\text{pH}} = 10$
C. ${\text{pH}} = 7$
D. ${\text{pH}} = 11$
Câu 17. Tính ${\text{pH}}$ của dung dịch ${\text{C}}{{\text{H}}_3}{\text{COOH}}0,1{\text{M}}$ biết ${{\text{K}}_{\text{a}}} = 1,8 \cdot {10^{ – 5}}$ ?
A. 1,00
B. 2,87
C. 6,05
D. 6,04
Câu 18. Tính ${\text{pH}}$ của dung dịch ${\text{N}}{{\text{H}}_3}0,1{\text{M}}$ biết ${{\text{K}}_{\text{b}}} = 1,8 \cdot {10^{ – 5}}$ ?
A. 2,876
B. 2,567
C. 11,124
D. 11,433
Câu 19. Tính ${\text{pH}}$ của dung dịch ${\text{HCOOH}}0,1{\text{M}}$ biết ${{\text{K}}_{\text{a}}} = 1,{6.10^{ – 4}}$ ?
A. 2,398
B. 3,973
C. 3,698
D. 2,673
Câu 20. Tính ${\text{pH}}$ của $200{\text{ml}}$ dung dịch ${\text{Ba}}{({\text{OH}})_2}$ biết để trung hòa dung dịch trên cần 0,02 mol HCl?
A. 12
B. 13
C. 11
D. 10
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
|
B |
C | D | A | D |
| 6 | 7 | 8 | 9 |
10 |
|
A |
B | A | A | B |
| 11 | 12 | 13 | 14 |
15 |
|
B |
A | C | C | B |
| 16 | 17 | 18 | 19 |
20 |
| A | B | C | A |
B |
Câu 1.
Lời giải
$\begin{array}{*{20}{r}}
{}&{\left[ {{{\text{H}}^ + }} \right] = 0,1 \cdot 2 = 0,2{\text{M}}} \\
{}&{ \to {\text{pH}} = – {\text{log}}\left[ {{{\text{H}}^ + }} \right]} \\
{}&{ \to {\text{pH}}0,7 < 1}
\end{array}$
Chọn B.
Câu 2.
Lời giải:
$\sum {{\text{n}}_{{\text{H}} + }} = 2 \cdot {{\text{n}}_{{\text{H}}2{\text{SO}}4}} + {{\text{n}}_{{\text{HCl}}}} = 2 \cdot 0,2 \cdot 0,05 + 0,3 \cdot 0,1 = 0,05{\text{M}}$
Thể tích dung dịch sau khi trộn bằng $200 + 300 = 500{\text{ml}}$
$ \to \left[ {{{\text{H}}^ + }} \right] = = 0,1{\text{M}}$
$ \to {\text{pH}} = – {\text{log}}\left[ {{{\text{H}}^ + }} \right] = 1$
Chọn C. $ \to {\text{nO}}{{\text{H}}_{{\text{Odu}}}} = {10^{ – 2}} \cdot 0,5 = 0,005{\text{mol}}$
${\text{n}}{{\text{O}}_{{\text{H}} – {\text{pu}}}} = {{\text{n}}_{{\text{H}} + {\text{pu}}}} = 0,015{\text{mol}}$
nOH-dư $ = $ nOH-ban đầu $ – {{\text{n}}_{{\text{OH}} – {\text{phanung}}}}$
$ \to 0,005 = 0,4{\text{a}} – 0,015 \to {\text{a}} = 0,05{\text{M}}$
Chọn B.
Câu 8.
Lời giải:
Gọi ${\text{V}}$ (lít) là thể tích dung dịch ${\text{NaOH}}$ cần thêm
$ \to {{\text{V}}_{{\text{ddX}}}} = 1 + {\text{V}}$ (lít)
${{\text{n}}_{{\text{NaOH}}}} = 1,8{\text{V}} = {{\text{n}}_{{\text{H}} + {\text{phanung}}}}$
${\text{pH}} = 1 \to $ dung dịch ${\text{X}}$ có môi trường acid $ \to $ acid dư $ \to \left[ {{{\text{H}}^ + }} \right]{\text{du}} = 0,1{\text{M}}$
$ \to {{\text{n}}_{{\text{H}} + {\text{du}}}} = 0,1.\left( {1 + {\text{V}}} \right)$
$ \to 2 = 1,8{\text{V}} + 0,1.\left( {1 + {\text{V}}} \right) \to {\text{V}} = 1$ lít
Chọn A.
Câu 9.
Lời giải:
Gọi V (lít) là thể tích của mỗi dung dịch
$\sum {{\text{n}}_{{{\text{H}}^ + }}} = {{\text{n}}_{{\text{HCl}}}} + 2{{\text{n}}_{{\text{H}}2{\text{SO}}4}} + {{\text{n}}_{{\text{HNO}}3}} = 0,3{\text{V}} + 2.0,1{\text{V}} + 0,2{\text{V}} = 0,7{\text{V}}$ mol
$ \to \left[ {{\text{H}} + } \right] = 0,7{\text{V}}/3{\text{V}} = 7/30 \to {\text{pH}} = – {\text{log}}\left[ {{{\text{H}}^ + }} \right] = 0,632$
Chọn A.
Câu 10.
Lời giải:
${{\text{n}}_{{\text{OH}} – }} = {{\text{n}}_{{\text{NaOH}}}} + {{\text{n}}_{{\text{KOH}}}} = 0,1 \cdot 0,02 + 0,2 \cdot 0,05 = 0,012{\text{mol}}$
${{\text{V}}_{{\text{ddX}}}} = 100 + 200 = 300{\text{ml}} = 0,3$ (lít)
$ \to \left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0,012/0,3 = 0,04{\text{M}} \to {\text{pOH}} = – {\text{log}}\left( {0,04} \right) = 1,40 \to {\text{pH}} = 14 – 1,40 = 12,6$.
Chọn B.
Câu 11.
Lời giải:
${\text{nO}}{{\text{H}}^ – } = 2{{\text{n}}_{{\text{Ba}}\left( {{\text{OH}}} \right)2}} = 2 \cdot 0,05 \cdot 0,05 = 0,005{\text{mol}}$
${{\text{n}}_{{\text{H}} + }} = {{\text{n}}_{{\text{HCl}}}} = 0,15 \cdot 0,02 = 0,003{\text{mol}}$
$ \to {\text{O}}{{\text{H}}^ – }{\text{du}}$
${{\text{n}}_{{\text{OH}} – {\text{pu}}}} = {{\text{n}}_{{\text{H}} + {\text{pu}}}} = 0,003{\text{mol}}$
$ \to {{\text{n}}_{{\text{OH}} – {\text{du}}}} = 0,002{\text{mol}} \to \left[ {{\text{O}}{{\text{H}}^ – }} \right]{\text{du}} = 0,002/0,2 = 0,01{\text{M}}$
$ \to {\text{pOH}} = – {\text{log}}\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 2 \to {\text{pH}} = 14 – 2 = 12$
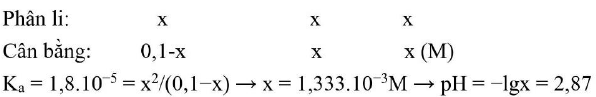
Chọn B.
Câu 18.
Lời giải:
Áp dụng công thức tính gần đúng ta có:
${\text{pOH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{b}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right) = 1/2\left[ { – {\text{lg}}\left( {1,8 \cdot {{10}^{ – 5}}} \right) – {\text{lg}}0,1} \right] \to {\text{pH}} = 14 – {\text{pOH}} = 11,124$.
Chọn C.
Câu 19.
Lời giải:
Áp dụng công thức tính gần đúng ta có:
${\text{pH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{a}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right) = 1/2\left[ { – {\text{lg}}\left( {1,{{6.10}^{ – 4}}} \right) – {\text{lg}}0,1} \right] = 2,398$
Chọn A.
Câu 20.
Lời giải:
Phương trình :
${\text{Ba}}{({\text{OH}})_2} \to {\text{B}}{{\text{a}}^{2 + }} + 2{\text{O}}{{\text{H}}^ – }$
${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
${\text{O}}{{\text{H}}^ – } + {{\text{H}}^ + } \to {{\text{H}}_2}{\text{O}}$
Ta có :
${{\text{n}}_{{\text{O}}{{\text{H}}^ – }}} = {{\text{n}}_{{{\text{H}}^ + }}} = 0,02{\text{mol}} \to \left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0,02/0,2 = 0,1{\text{M}} \to {\text{pH}} = 14 + {\text{lg}}\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 13$
Chọn B.








Add ơi hỗ trợ cho tải file, add ơi
Bạn tải lại ở trên nhé.